
| 实验目的 | 实验方案 | |
| A | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| C | 验证乙炔能被酸性高锰酸钾溶液氧化 | 将电石与饱和食盐水反应生成的气体通入酸性高锰酸钾溶液,观察溶液是否褪色 |
| D | 验证苯和液溴在FeBr3的催化下发生取代反应 | 将反应产生的混合气体先通入溴的四氯化碳溶液再通入AgNO3溶液中,观察是否有淡黄色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溴乙烷和NaOH的乙醇溶液,加热,发生消去反应生成乙烯;
B.NaOH过量,可生成氢氧化镁、氢氧化铁沉淀;
C.电石不纯,与水反应生成乙炔的同时也生成硫化氢、磷化氢等;
D.溴易挥发,生成的HBr中含有溴,溴的四氯化碳溶液可除掉溴.
解答 解:A.溴乙烷和NaOH的乙醇溶液,加热,发生消去反应生成乙烯,乙烯可发生加成反应,溴的四氯化碳溶液褪色,故A正确;
B.NaOH过量,可生成氢氧化镁、氢氧化铁沉淀,不能发生沉淀的转化,故B错误;
C.电石不纯,与水反应生成乙炔的同时也生成硫化氢、磷化氢等,都可与高锰酸钾溶液反应,应先除杂,故C错误;
D.溴易挥发,生成的HBr中含有溴,溴的四氯化碳溶液可除掉溴,再通入AgNO3溶液中,观察是否有淡黄色沉淀生成,可检验,故D正确;
故选BC.
点评 本题考查化学实验方案的评价,为高频考点,涉及有机物的性质、沉淀转化和生成、产物检验等,把握物质的性质及反应原理为解答的关键,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
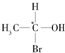 等,则下列化合物中存在对映异构体的是( )
等,则下列化合物中存在对映异构体的是( )| A. | CH3COOH | B. | CH3COCH3 | ||
| C. | 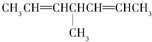 | D. | 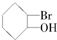 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解MgCl2饱和溶液,可制得金属镁 | |
| B. | 镀锡铁制品和镀锌铁制品的镀层破损时,镀锡铁中铁的腐蚀速率更快 | |
| C. | 在轮船船体四周镶嵌锌块保护船体不受腐蚀的方法叫牺牲阳极的阴极保护法 | |
| D. | 不锈钢有较强的抗腐蚀能力是因为在钢铁表面镀上了铬 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;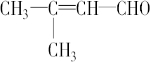 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4可以由CH4制得,它可用于萃取碘水中的碘 | |
| B. | 相等的物质的量的乙烯和甲烷完全燃烧后产生的水的质量相同 | |
| C. | 用乙烯与HCl反应来制备氯乙烷比用乙烷与氯气反应更好 | |
| D. | 甲烷的空间构型是正四面体,所以二氯甲烷有两种不同的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ③④⑤ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
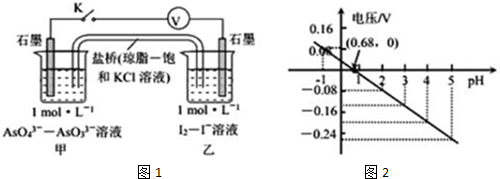
| A. | pH>0.68时,甲烧杯中石墨为负极 | |
| B. | pH=0.68时,反应处于平衡状态 | |
| C. | pH<0.68时,氧化性I2<AsO43- | |
| D. | pH=5时,负极电极反应式为2I--2e-=I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com