
| A. | 与稀盐酸反应放出气体的快慢:Na2CO3>NaHCO3 | |
| B. | 配制成同物质的量浓度的溶液时,溶液的pH:Na2CO3>NaHCO3 | |
| C. | 106gNa2CO3和84gNaHCO3分别与过量的盐酸反应,放出CO2的质量:Na2CO3>NaHCO3 | |
| D. | 在Na2CO3和NaHCO3的稀溶液中,加CaCl2溶液都有白色沉淀生成 |
分析 NaHCO3与Na2CO3相比较,NaHCO3不稳定,加热易分解,常温时,Na2CO3溶解度较大,与盐酸反应时,NaHCO3反应剧烈,Na2CO3水解程度较大,溶液碱性较强,以此解答该题.
解答 解:A.分别滴加HCl溶液,反应离子方程式为CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,故A错误;
B.Na2CO3水解程度较大,溶液碱性较强,pH较大,故B正确;
C.106gNa2CO3和84gNaHCO3的物质的量都为1mol,都与盐酸反应生成二氧化碳气体:Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaHCO3+HCl=NaCl+H2O+CO2↑,等物质的量的Na2CO3和NaHCO3分别与过量盐酸反应,放出CO2质量相等,故C错误;
D.在Na2CO3和NaHCO3的稀溶液中,加CaCl2溶液,只有碳酸钠溶液生成沉淀,故D错误.
故选B.
点评 本题考查Na2CO3和NaHCO3性质的异同,侧重于学生的分析能力和计算能力的考查,题目难度不大,注意把握Na2CO3和NaHCO3性质,注重基础知识的积累.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
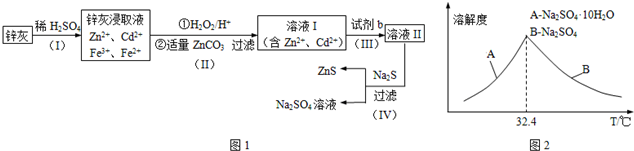
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
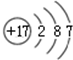 ②
②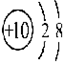 ③
③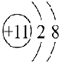 ④
④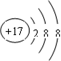
| A. | ①②两种粒子所属的元素在元素周期表的同一横行 | |
| B. | ②③④对应的元素化学性质相似 | |
| C. | ①③对应的元素是同一周期元素 | |
| D. | ③④可形成X2Y型化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(CO2)=v(CO) | B. | 容器中总压强不变 | ||
| C. | 容器中混合气体的密度不变 | D. | 各组分浓度不再随时间而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
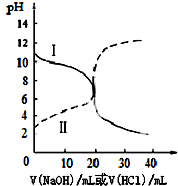 25℃时,取浓度均为0.1mol•L-1的醋酸溶液和氨水溶液各20mL,分别用浓度均为0.1mol•L-1NaOH溶液和盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )
25℃时,取浓度均为0.1mol•L-1的醋酸溶液和氨水溶液各20mL,分别用浓度均为0.1mol•L-1NaOH溶液和盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )| A. | 曲线Ⅰ:滴加溶液到20 mL时溶液的pH=5则:c(H+)-c((NH3•H2O)=c(OH-)=1×10-9 mol•L-1 | |
| B. | 曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) | |
| D. | 曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com