
【题目】向mg镁和铝的混合物重加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL.向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng.再将得到的沉淀灼烧至质量不再改变为止,得到固体pg.则下列关系不正确的是( )
A.c= ![]()
B.p=m+ ![]()
C.n=m+17Vc
D.![]() m<p<
m<p< ![]() m
m
【答案】C
【解析】解:A.根据电荷守恒,氢氧化镁、氢氧化铝沉淀中含有n(OH﹣),等于金属提供的电子的物质的量,等于生成氢气的获得的电子的物质的量,故生成的氢气的物质的量等于参加反应的碱的物质的量的一半,故 ![]() ×2=cmol/L×V×10﹣3L,整理得c=
×2=cmol/L×V×10﹣3L,整理得c= ![]() ,故A正确;
,故A正确;
B.选项中p为生成的氧化物的质量,由Mg(OH)2 ![]() MgO+H2O,2Al(OH)3
MgO+H2O,2Al(OH)3 ![]() Al2O3+3H2O可知,氧化物的质量等于金属质量与氧原子的质量之和,由方程式可知氧原子的物质的量等于氢氧根离子物质的量的一半,故p=m+c×V×10﹣3×
Al2O3+3H2O可知,氧化物的质量等于金属质量与氧原子的质量之和,由方程式可知氧原子的物质的量等于氢氧根离子物质的量的一半,故p=m+c×V×10﹣3× ![]() ×16=m+
×16=m+ ![]() ,故B正确;
,故B正确;
C.沉淀为氢氧化镁、氢氧化铝,其质量等于金属的质量与含有的氢氧根离子的质量之和,故n=m+c×V×10﹣3×17=m+ ![]() ,故C错误;
,故C错误;
D.得到的氧化物为氧化镁,根据元素守恒,则质量为P= ![]() ×40=
×40= ![]() ,若mg全是铝,得到的氧化物为氧化铝,根据元素守恒,则质量为p=
,若mg全是铝,得到的氧化物为氧化铝,根据元素守恒,则质量为p= ![]() ×
× ![]() ×102=
×102= ![]() ,质量介于二者之间,故D正确;
,质量介于二者之间,故D正确;
故选C.
反应化学方程式为:Mg+H2SO4=MgSO4+H2↑;2Al+3H2SO4=Al2(SO4)3+3H2↑;MgSO4+2KOH=Mg(OH)2↓+K2SO4;Al2(SO4)3+6KOH=2Al(OH)3↓+3K2SO4;Mg(OH)2 ![]() MgO+H2O;2Al(OH)3
MgO+H2O;2Al(OH)3 ![]() Al2O3+3H2O;
Al2O3+3H2O;
A.根据n= ![]() 计算氢气的物质的量,根据电荷守恒,氢氧化镁、氢氧化铝沉淀中含有n(OH﹣)等于金属提供的电子的物质的量,等于生成氢气的获得的电子的物质的量,据此计算氢氧根离子的物质的量,再根据c=
计算氢气的物质的量,根据电荷守恒,氢氧化镁、氢氧化铝沉淀中含有n(OH﹣)等于金属提供的电子的物质的量,等于生成氢气的获得的电子的物质的量,据此计算氢氧根离子的物质的量,再根据c= ![]() 计算氢氧化钾的物质的量浓度;
计算氢氧化钾的物质的量浓度;
B.由Mg(OH)2 ![]() MgO+H2O,2Al(OH)3
MgO+H2O,2Al(OH)3 ![]() Al2O3+3H2O可知,沉淀灼烧生成氧化镁与氧化铝,二者质量等于金属质量与氧原子的质量之和,由方程式可知氧原子的物质的量等于氢氧根离子物质的量的一半,据此计算;
Al2O3+3H2O可知,沉淀灼烧生成氧化镁与氧化铝,二者质量等于金属质量与氧原子的质量之和,由方程式可知氧原子的物质的量等于氢氧根离子物质的量的一半,据此计算;
C.沉淀为氢氧化镁、氢氧化铝,其质量等于金属的质量与含有的氢氧根离子的质量之和,根据n=cVM计算氢氧根离子的质量;
D.按照极值方法计算,若mg全是镁,计算生成得到的氧化镁质量,若mg全是铝,计算得到的氧化铝的质量,实际固体的质量介于二者之间.


科目:高中化学 来源: 题型:
【题目】在一个1L的密闭容器中,加入2molA和1molB,发生下述反应:2A(g)+B(g)3C(g)+D(s),达到平衡时,C的浓度为1.2mol/L.若维持容器的体积和温度不变,反应从逆反应开始,按不同配比作为起始物质,达到平衡时,C的浓度仍是1.2mol/L,则D的起始物质的量应满足的条件应是( )
A.大于0.6mol
B.大于零
C.等于1mol
D.任意值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150mL 4molL﹣1的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为 ( )
A.0.21mol
B.0.25mol
C.0.3mol
D.0.35mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10﹣a mol/L,c(OH﹣)=10﹣b mol/L,已知a+b=13,则在该温度下,将100mL 0.10mol/L的稀硫酸与100mL 0.40mol/L的NaOH溶液混合后,溶液的pH为(已知:忽略混合时体积的变化;lg2=0.30;lg3=0.48)( )
A.11.52
B.11.70
C.11.82
D.12.00
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.Na2O2晶体中,阴、阳离子个数比是1∶1
B.NaCl晶胞中有1个Na+和1个Cl-
C.CaF2晶体中,Ca2+和F-的配位数之比为1∶2
D.CsCl晶胞中,Cl-的配位数是8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在有图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热.下列说法正确的是( ) 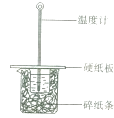
A.实验过程中没有热量损失
B.烧杯间填满碎纸条的作用是固定小烧杯
C.图中实验装置缺少环形玻璃搅拌棒
D.若将盐酸体积改为60mL,理论上所求中和热不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质. 请回答下列问题:
(1)装置中湿棉花的作用 . 硬质试管中发生反应的化学方程式为 .
(2)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案: ①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是 .
若溶液未变红色,则说明硬质试管中固体物质的成分是 .
(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是: . (用离子方程式表示).
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应.若按如图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出白色沉淀变成红褐色沉淀所发生发应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示: 
(1)95℃时水的离子积KW=
(2)95℃时,0.01mol/LNaOH溶液的PH= .
(3)95℃时水的电离平衡曲线应为(填“A”或“B”),请说明理由 .
(4)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为 .
(5)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 .
(6)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5.请分析原因: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸丁酯(CH3COOCH2CH2CH2CH3)是具有果香味的香精,经酯化反应可进行乙酸丁酯的合成.有关物质的物理性质见表.合成过程如下:第一步:将丁醇和过量的乙酸混合加热发生酯化反应;第二步:洗涤提纯;第三步:蒸馏提纯.
乙酸 | 1﹣丁醇 | 乙酸丁酯 | |
熔点/℃ | 16.6 | ﹣89.5 | ﹣73.5 |
沸点/℃ | 117.9 | 117 | 126.3 |
密度/gcm﹣3 | 1.05 | 0.81 | 0.88 |
水溶性 | 互溶 | 互溶 | 不溶 |

(1)上述是合成和提纯乙酸丁酯的有关装置图,请写出合成和提纯乙酸丁酯的操作顺序(填字母)
C→F→→→→ .
(2)C装置中除了装有1﹣丁醇和过量的乙酸外,还需要加入、 . 装置C中冷凝管的作用是:;
(3)步骤F:酯化反应完成后,向卸下的烧瓶中加入25mL水的作用是 . A装置中Na2CO3溶液的作用是 .
(4)装置A的分液漏斗中液体分为两层,乙酸丁酯应在(填上、下)层.
(5)第一步酯化反应过程中可能得到的有机副产物有(写出两种物质的结构简式).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com