
【题目】有机物的结构可用“键线式”表示,如CH3CH=CHCH3可简写为![]() 。有机物X的键线式为
。有机物X的键线式为![]() ,下列说法不正确的是( )
,下列说法不正确的是( )
A. X的化学式为C8H8
B. 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为![]()
C. X能使酸性高锰酸钾溶液褪色
D. X与足量的H2在一定条件下反应可生成饱和烃Z, Z的一氯代物有4种
【答案】D
【解析】
键线式中交点为碳原子,利用碳四价理论补足每个碳上的氢原子数来确定该物质的分子式;芳香烃是含有苯环的烃;从所给的键线式中可以看出X含有多个碳碳双键;在一定条件下反应可将X中所有的碳碳双键催化加氢,Z具有高度对称的结构。
A.由X的键线式可以知道,分子中有8个碳原子、8个氢原子,所以分子式为C8H8,A项正确;
B.与X互为同分异构体且属于芳香烃,Y中必有苯环,去掉C6H5还剩2个碳3个氢,只能是乙烯基,所以Y的结构简式是![]() ,B项正确;
,B项正确;
C.X的结构中含有碳碳双键,可以使酸性高锰酸钾溶液褪色,C项正确;
D.Z中只有两种环境的氢原子,所以一氯代物只有2种,D项错误;
所以答案选择D项。


科目:高中化学 来源: 题型:
【题目】工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分NaClO)。一化学小组在室温下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO3-等离子的物质的量(mol)与反应时间t(min)的关系曲线。下列说法不正确的是
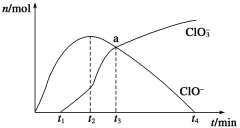
A. 工业制取漂白液的化学反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O
B. a点时溶液中各离子浓度:c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)>c(OH-)>c(H+)
C. t2~t4,ClO-离子的物质的量下降的原因可能是3ClO-= 2Cl-+ClO3-
D. 使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴甲基橙指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是________ →________ →________ →D→________(均用字母填写)。
(2)滴定管的读数应注意_________________________________。
(3)E中在锥形瓶下垫一张白纸的作用是____________________。
(4)D步骤中液面应调节到____________________,尖嘴部分应__________________。
(5)滴定终点时锥形瓶内溶液的pH约为________,终点时颜色变化是_____________________________________________________。
(6)若酸式滴定管不用标准硫酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?________(填“偏高”“偏低”或“不变”)。
(7)该烧碱样品纯度的计算式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1
则M、N相比,较稳定的是 。
(2)已知CH3OH(l)的燃烧热为238.6 kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式: 。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试回答下列各题:
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ______________________________。
(2)化学反应的焓变与反应物和生成物的键能有关。
①已知:H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ·mol-1
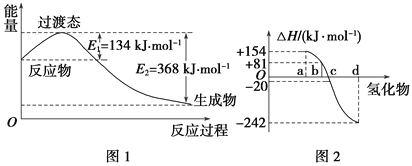
请填空:
共价键 | H—H | Cl—Cl | H—Cl |
键能/(kJ·mol-1) | 436 | 247 | ________ |
②图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式: ___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将甘油(C3H8O3)转化为高附值产品是当前热点研究方向,如甘油和水蒸气、氧气经催化重整或部分催化氧化可制得氢气,反应主要过程如下:

(1)下列说法正确的是______(填字母序号)。
a.消耗等量的甘油,反应I的产氢率最高
b.消耗等量的甘油,反应II的放热最显著
c.经过计算得到反应III的H3=-237.5 kJ/mol,
d.理论上,通过调控甘油、水蒸气、氧气的用量比例可以实现自热重整反应,即焓变约为0,这体现了科研工作者对吸热和放热反应的联合应用
(2)研究人员经过反复试验,实际生产中将反应III设定在较高温度(600~700°C)进行,选择该温度范围的原因有:催化剂活性和选择性高、____________。
(3)研究人员发现,反应I的副产物很多,主要含有:CH4、C2H4、CO、CO2、CH3CHO、CH3COOH等,为了显著提高氢气的产率,采取以下两个措施。
①首要抑制产生甲烷的副反应。从原子利用率角度分析其原因:__________________。
②用CaO吸附增强制氢。如图1所示,请解释加入CaO的原因:____________________。
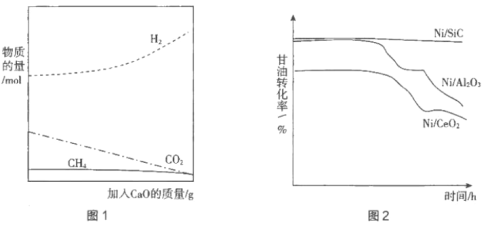
(4)制备高效的催化剂是这种制氢方法能大规模应用于工业的重要因素。通常将Ni分散在高比表面的载体(SiC、Al2O3、CeO2)上以提高催化效率。分别用三种催化剂进行实验,持续通入原料气,在一段时间内多次取样,绘制甘油转化率与时间的关系如图2所示。
①结合图2分析Ni/SiC催化剂具有的优点是____________________。
②研究发现造成催化效率随时间下降的主要原因是副反应产生的大量碳粉(积碳)包裹催化剂,通过加入微量的、可循环利用的氧化镧(La2O3)可有效减少积碳。其反应机理包括两步:
第一步为:La2O3+CO2 ![]() La2O2CO3
La2O2CO3
第二步为:______________________________(写出化学反应方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述中正确的是
4NO(g)+6H2O(g),下列叙述中正确的是
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大
D. 化学反应速率的关系是2v逆(NH3)=3v正(H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com