
氮化硅(Si3N4)是一种新型陶瓷材料,它可在高温下的氮气流中由石英与焦炭通过以下反应制得:3SiO2(s) + 6C(s) + 2N2(g) Si3N4(s) + 6CO(g) + Q(Q>0)
Si3N4(s) + 6CO(g) + Q(Q>0)
完成下列填空:
(1)某温度下该反应在一容积为2L的密闭容器中进行,2min后达到平衡,刚好有2mol电子发生转移,则2min内反应的速率为:v(CO) = ;该反应的平衡常数表达式为 。
(2)其它条件不变时仅增大压强,则 。
a.K值减小,平衡向逆反应方向移动
b.K值增大,平衡向正反应方向移动
c.K值不变,平衡向逆反应方向移动
d.K值不变,平衡向正反应方向移动
(3)一定条件下能说明上述反应已达平衡的是 。
a.c(N2 ) : c(CO) = 1:3 b.3v(N2 ) = v(CO)
c.固体质量不再改变 d.气体密度不再改变
达到平衡后改变某一条件,反应速率v与时间t的关系如图所示。

若不改变N2与CO的量,则图中t4时引起变化的原因可能是 ;图中t6时引起变化的原因可能是 。
由图可知,平衡混合物中CO含量最高的时间段是 。
(1)0.25 mol/L·min(1分,计算或单位错不给分); K=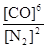 (1分)(2)c (1分)
(1分)(2)c (1分)
(3)c、d(1分×2)33、升高温度或缩小体积(增大压强)(1分);加入了催化剂(1分)。
t3~t4(1分)。
【解析】
试题分析:(1)可逆反应3SiO2(s)+6C(s)+2N2(g)⇌Si3N4(s)+6CO(g)的平衡常数k=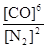 该反应为放热反应,升高温度平衡逆反应进行,化学平衡常数减小;(2)由方程式可知,该反应正反应是气体物质的量增大的反应,混乱度增大,熵值增大,故△S>0;故答案为:>;(3)A.单位时间生成2摩尔Si3N4的同时生成1摩尔的N2,生成2摩尔Si3N4的消耗4molN2,氮气的生成速率与消耗速率不相等,反应未达平衡状态,故A错误;B.平衡时c(N2)与c(CO)之比为1:3,可能处于平衡状态,也可能不处于平衡状态,与氮气的转化率等有关,故B错误;C.平衡时平衡体系个组分的含量不变,CO的百分含量保持不变,说明到达平衡状态,故C正确;D.单位时间消耗1摩尔SiO2的同时生成2摩尔的C,消耗1摩尔SiO2需要消耗2molC,C的生成速率与消耗速率相等,反应达平衡状态,故D正确;故选CD;(4)若不改变N2、CO的量,由图可知,t4时瞬间正、逆反应都增大,平衡向逆反应移动,改变条件为升高温度后压缩体积增大压强;t6时瞬间正、逆反应都增大,平衡不移动,故应是加入催化剂;t2时改变改变条件,平衡向正反应移动,在t3时重新到达平衡,t4时改变条件,平衡向逆反应移动,t5时由达平衡,故t3~t4平衡状态CO的含量最高;故答案为:升高温度后压缩体积增大压强;加入催化剂;t3~t4。
该反应为放热反应,升高温度平衡逆反应进行,化学平衡常数减小;(2)由方程式可知,该反应正反应是气体物质的量增大的反应,混乱度增大,熵值增大,故△S>0;故答案为:>;(3)A.单位时间生成2摩尔Si3N4的同时生成1摩尔的N2,生成2摩尔Si3N4的消耗4molN2,氮气的生成速率与消耗速率不相等,反应未达平衡状态,故A错误;B.平衡时c(N2)与c(CO)之比为1:3,可能处于平衡状态,也可能不处于平衡状态,与氮气的转化率等有关,故B错误;C.平衡时平衡体系个组分的含量不变,CO的百分含量保持不变,说明到达平衡状态,故C正确;D.单位时间消耗1摩尔SiO2的同时生成2摩尔的C,消耗1摩尔SiO2需要消耗2molC,C的生成速率与消耗速率相等,反应达平衡状态,故D正确;故选CD;(4)若不改变N2、CO的量,由图可知,t4时瞬间正、逆反应都增大,平衡向逆反应移动,改变条件为升高温度后压缩体积增大压强;t6时瞬间正、逆反应都增大,平衡不移动,故应是加入催化剂;t2时改变改变条件,平衡向正反应移动,在t3时重新到达平衡,t4时改变条件,平衡向逆反应移动,t5时由达平衡,故t3~t4平衡状态CO的含量最高;故答案为:升高温度后压缩体积增大压强;加入催化剂;t3~t4。
考点:考查化学平衡常数与影响因素、平衡状态判断、影响平衡移动的因素与平衡图象等,比较基础,注意方程式中物质的状态,理解外界条件对反应速率的影响。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |


查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、氮化硅陶瓷可用于制造汽车发动机 |
| B、氮化硅中氮元素的化合价为─3 |
| C、氮化硅陶瓷属于新型无机非金属材料 |
| D、氮化硅不会与任何酸发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(N2)/mol | 2.00 | 1.40 | 1.12 | 1.00 | 1.00 | 1.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com