(2012?浦东新区二模)乙醚极易挥发、微溶于水、是良好的有机溶剂.乙醇与浓硫酸的混合物在不同温度下反应能生成乙烯或乙醚.某实验小组用如图装置制取乙醚和乙烯.

(1)制乙醚:在蒸馏烧瓶中先加入10mL乙醇,慢慢加入10mL浓硫酸,冷却,固定装置.加热到140℃时,打开分液漏斗活塞,继续滴加10mL乙醇,并保持140℃,此时烧瓶c中收集到无色液体.
(1)Ⅰ和Ⅱ是反应发生装置,应该选择
Ⅰ
Ⅰ
(选答“Ⅰ”或“Ⅱ”)与装置Ⅲ相连.
(2)乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是
防止乙醇挥发
防止乙醇挥发
.
(2)Ⅲ中水冷凝管的进水口是
b
b
(选答“a”或“b”).冰盐水的作用是
冷凝液化乙醚
冷凝液化乙醚
.
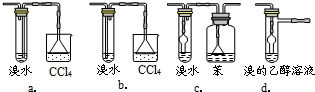
(3)有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险.该同学设计了以下几种装置与导管d连接,你认为合理的是(选填编号)
c、d
c、d
.
(4)反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色.写出实验过程中所有生成气体的反应方程式
CH
3CH
2OH+6H
2SO
42CO
2↑+6SO
2↑+9H
2O;C+2H
2SO
4CO
2↑+2SO
2↑+2H
2O;CH
3CH
2OH
C
2H
4↑+H
2O;CH
3CH
2OH+2H
2SO
42C+2SO
2↑+5H
2O
CH
3CH
2OH+6H
2SO
42CO
2↑+6SO
2↑+9H
2O;C+2H
2SO
4CO
2↑+2SO
2↑+2H
2O;CH
3CH
2OH
C
2H
4↑+H
2O;CH
3CH
2OH+2H
2SO
42C+2SO
2↑+5H
2O
.
(5)实验中收集到的乙醚产品中可能含有多种杂质.某同学设计了以下提纯方案:

①分液步骤除去产品中的酸性杂质,则X可以是
NaOH
NaOH
.
②蒸馏操作可除去的杂质是
乙醇(CH3CH2OH)
乙醇(CH3CH2OH)
.
(6)工业乙醚常因接触空气和光而被氧化,含有少量过氧化物,除去过氧化物的试剂及操作分别是(选填编号)
b、d
b、d
.
a.CCl
4、萃取 b.Na
2SO
3溶液、分液
c.Na
2SO
4溶液、过滤 d.酸化的FeSO
4溶液、分液.





