
| A. | CuCl2溶液蒸干灼烧后得到CuCl2固体 | |
| B. | 火力发电的目的是使化学能转换为电能 | |
| C. | 已知C(石墨,s)=C(金刚石,s)△H>0,无法比较二者的稳定性. | |
| D. | 将FeCl3固体溶于适量蒸馏水来配制FeCl3溶液 |
分析 A.水解生成盐酸易挥发;
B.火力发电,利用化学反应中能量最终转化为电能;
C.由C(石墨,s)=C(金刚石,s)△H>0,可知石墨的能量低;
D.配制FeCl3溶液,应加盐酸抑制水解.
解答 解:A.水解生成盐酸易挥发,则CuCl2溶液蒸干灼烧后得到CuO,故A错误;
B.火力发电,利用化学反应中能量最终转化为电能,则可使化学能转换为电能,故B正确;
C.由C(石墨,s)=C(金刚石,s)△H>0,可知石墨的能量低,可知石墨比金刚石稳定,故C错误;
D.配制FeCl3溶液,应加盐酸抑制水解,则FeCl3固体溶于适量盐酸,故D错误;
故选B.
点评 本题考查反应热、盐类水解,为高频考点,把握稳定性与能量的关系、水解原理及应用为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
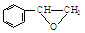 或
或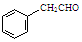 ,某种咔咯铁的配合物能将温室气体CO2转化为CO${\;}_{3}^{2-}$和CO.
,某种咔咯铁的配合物能将温室气体CO2转化为CO${\;}_{3}^{2-}$和CO.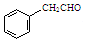 分子中碳原子轨道的杂化类型是sp2、sp3,1mol
分子中碳原子轨道的杂化类型是sp2、sp3,1mol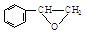 分子中含有σ键的数目为18mol.
分子中含有σ键的数目为18mol.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
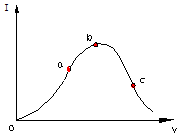 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量是32 g | B. | 体积是44.8 L | ||
| C. | 分子数是1.204×1024 | D. | 原子数是2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| KSP | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-23 |
| 实验编号 | 起始浓度/mol/L | 反应后溶液的pH | |
| c (HA) | c (NaOH) | ||
| ① | 0.10 | 0.10 | 9 |
| ② | X | 0.05 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mn2+的还原性弱于H2O2 | |
| B. | MnO4-是氧化剂,O2是氧化产物 | |
| C. | 生成lmol O2时,转移4 mol电子 | |
| D. | 离子方程式中按物质顺序的化学计量数是2、5、6、2、5、8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 应量取的浓盐酸的体积是10.0mL | |
| B. | 若开始时洁净的容量瓶中有少许蒸馏水,对实验没有影响 | |
| C. | 量取浓盐酸时,因浓盐酸有挥发性,所以要多量取lmL浓盐酸 | |
| D. | 定容摇匀后,发现液面低于刻度线,应立即加少量蒸馏水补至刻度线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com