
|
高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂. 湿法制备的主要反应方程为:2Fe(OH)3+3ClO―+4OH―=2FeO42-+3Cl―+5H2O 干法制备的主要反应方程为:2FeSO4+4Na2O2=2Na2FeO4+2Na2SO4 下列有关说法不正确的是 | |
| [ ] | |
A. |
高铁酸钠中铁显+3价 |
B. |
湿法中每生成1 mol Na2FeO4转移3 mol电子 |
C. |
干法中每生成1 mol Na2FeO4转移4 mol电子 |
D. |
Na2FeO4处理水时消毒杀菌的原理与HClO相同 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、钢铁制品被锈蚀主要是因为钢铁中含有碳而发生原电池反应,因此生铁炼钢时要尽可能完全除去生铁中的碳 | B、海水淡化和工业生产及生活的废水再利用,是解决缺水问题的有效途径之一 | C、高铁酸钠Na2FeO4和Cl2O都能作为净水剂,其原理完全相同 | D、液氯罐泄漏时,可将其移入水塘中,并向水塘中加入生石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的。它是由硝酸铁、氢氧化钠和氯气在一定条件下制得的,同时还生成硝酸钠和氯化钠等。
① 写出制取高铁酸钠的化学方程式: ;
② 在制取高铁酸钠的反应中 元素被氧化;
③ 高铁酸钠杀菌作用是利用了其具有的 ,而净水作用的原因是 。
(2)在某化工厂生产中,要用到一种无色、可溶于水的晶体铝铵矾。该晶体是一种复盐,其主要化学成分为十二水合硫酸铝铵。向该复盐的溶液中逐滴加入氢氧化钠溶液,将发生一系列变化。已知,NH4+与AlO2-在水溶液中不能大量共存,会发生如下反应:NH4++A1O2-+H2O=Al(OH)3↓+ NH3↑ ,试回答:
① 硫酸铝铵在水溶液中的电离方程式为 ;
② 在向该复盐的溶液中逐滴加入氢氧化钠溶液,请在下图中画出加入氢氧化钠溶液的体积与沉淀物质的量之间的关系。
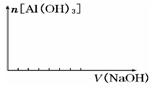
查看答案和解析>>
科目:高中化学 来源:2010年浙江省瑞安中学高三上学期10月月考(化学) 题型:填空题
(11分)(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的。它是由硝酸铁、氢氧化钠和氯气在一定条件下制得的,同时还生成硝酸钠和氯化钠等。
①写出制取高铁酸钠的化学方程式: ;
②在制取高铁酸钠的反应中 元素被氧化;
③高铁酸钠之所以有净水作用,除杀菌外,另一个原因是 。
(2)在某化工厂生产中,要用到一种无色、可溶于水的晶体铝铵矾。该晶体是一种复盐,其主要化学成分为十二水合硫酸铝铵。向该复盐的浓溶液中逐滴加入浓氢氧化钠溶液。将发生一系列变化。已知,NH4+与AlO2—在水溶液中不能大量共存,会发生如下反应:NH4++A1O2—+H2O=Al(OH)3↓+ NH3↑
试回答:
①硫酸铝铵在水溶液中的电离方程式为 ;
②在逐滴加入浓氢氧化钠溶液的过程中,产生的现象有:a溶液中出现白色沉淀;b有刺激性气体逸出;c白色沉淀量逐渐增多;d白色沉淀完全消失;e白色沉淀逐渐减少。
请回答各种现象由先到后出现的顺序是(用序号回答): 。
③并在下图中画出氢氧化钠的加入体积与沉淀量的关系.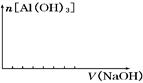
查看答案和解析>>
科目:高中化学 来源:2013届山东省聊城市东昌府区高三9月模拟调研(四)化学试卷(带解析) 题型:填空题
某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。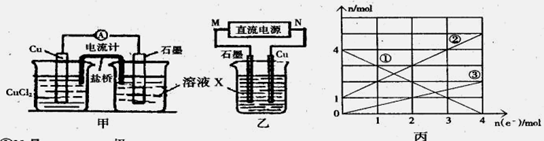
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
①图中X溶液是 ;
②Cu电极上发生的电极反应式为 ;
③原电池工作时,盐桥中的 离子(填“K+”或“Cl—”)不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是 极;
②图丙中的②线是_______________离子的变化。
③当电子转移为2mol时,向乙烧杯中加入 L 5mol·L-1NaOH溶液才能使所有的金属阳离子沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O
 Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为 。
③Na2FeO4能消毒、净水的原因 。
查看答案和解析>>
科目:高中化学 来源:2015届北京市朝阳区高一上学期期末考试化学试卷(解析版) 题型:选择题
高铁酸钠(Na2FeO4)是一种高效的饮用水处理剂,工业上可由下列方法制得:Fe2O3+3Na2O2 2Na2FeO4+Na2O
2Na2FeO4+Na2O
关于该反应说法正确的是
A、反应中Na2O2是氧化剂
B、Fe2O3可以通过铁丝在氧气中燃烧制得
C、生成1 mol Na2FeO4,有6 mol电子转移
D、在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com