
分析 无色溶液,一定不含紫色的MnO4-,
由A可知,气体为二氧化碳,则一定含CO32-,与CO32-反应的Ag+、Ba2+、Al3+不能大量存在;
由B可知,Al3+、HCO3-相互促进生成气体甲为二氧化碳,沉淀甲为氢氧化铝,则原溶液一定含AlO2-;
由C可知,气体为铵根离子与碱反应生成的氨气,沉淀乙中一定含碳酸钡,可能含硫酸钡,以此来解答.
解答 解:无色溶液,一定不含紫色的MnO4-,
由A可知,气体为二氧化碳,则一定含CO32-,与CO32-反应的Ag+、Ba2+、Al3+不能大量存在;
由B可知,Al3+、HCO3-相互促进生成气体甲为二氧化碳,沉淀甲为氢氧化铝,则原溶液一定含AlO2-;
由C可知,气体为铵根离子与碱反应生成的氨气,沉淀乙中一定含碳酸钡,可能含硫酸钡,
(1)溶液中一定不存在的离子是MnO4-、Ag+、Ba2+、Al3+,故答案为:MnO4-、Ag+、Ba2+、Al3+;
(2)由以上分析可知一定存在的离子是CO32-、Na+、AlO2-,B中生成沉淀甲的离子方程式是为Al3++3 HCO3-=3 CO2↑+Al (OH)3↓,
故答案为:Na+、AlO2-、CO32-;Al3++3HCO3-═Al(OH)3↓+3CO2↑;
(3)白色沉淀乙一定含有碳酸钡,可能含有硫酸钡,可加入盐酸检验,如沉淀部分溶解,则含有碳酸钡和硫酸钡,如沉淀全部溶解,则只含碳酸钡,
故答案为:加入盐酸,观察沉淀是否全部溶解,若全部溶解,说明只有BaCO3,若部分溶解则还含有BaSO4.
点评 本题考查无机物的推断,为高频考点,把握离子的颜色、离子之间的反应为解答的关键,侧重分析与推断能力的考查,注意水解原理应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
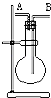 某学生想利用如图装置(烧瓶位置不能移动)收集下列气体:①H2; ②Cl2;③SO2;④HCl;⑤NH3;⑥NO;⑦NO2.下列说法正确的是( )
某学生想利用如图装置(烧瓶位置不能移动)收集下列气体:①H2; ②Cl2;③SO2;④HCl;⑤NH3;⑥NO;⑦NO2.下列说法正确的是( )| A. | 烧瓶是干燥的,由B进气,可收集②③④⑥⑦ | |
| B. | 烧瓶是干燥的,由A进气,可收集①⑤ | |
| C. | 在烧瓶中充满水,由A进气,可收集①⑤⑦ | |
| D. | 在烧瓶中充满水,由B进气,可收集⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 直径介于1nm-100nm之间的微粒称为胶体 | |
| C. | 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 | |
| D. | 溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y | Z |  |
| A | 含氧酸 | 一元强酸 | HclO4 | |
| B | 易溶碱 | 强碱 | NaOH | |
| C | 盐 | 酸式盐 | NaHCO3 | |
| D | 非电解质 | 氧化物 | CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
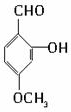
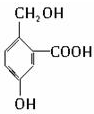
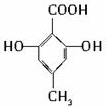
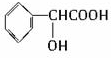
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
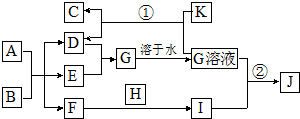 在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,K是黑色固体,D和F反应可用于工业上生产漂白液,H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和反应条件未列出)
在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,K是黑色固体,D和F反应可用于工业上生产漂白液,H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和反应条件未列出)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
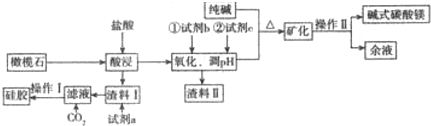
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | 温度 | 初始pH | 0.1 mol/L草酸溶液/mL | 0.01mol/LKMnO4溶液体积/mL | 蒸馏水体积/mL | 待测数据(反应混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | t3 |
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
| 往反应混合液中加入少量MnSO4固体,控制其他反应条件与实验①相同,进行对比实验 | 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com