
已知2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ•mol﹣1 CO(g)+ O2(g)=CO2(g)△H=﹣283kJ•mol﹣1某H2和CO的混合气体完全燃烧时放出113.74kJ热量,同时生成3.6g液态水,求原混合气体中H2和CO的物质的量.
O2(g)=CO2(g)△H=﹣283kJ•mol﹣1某H2和CO的混合气体完全燃烧时放出113.74kJ热量,同时生成3.6g液态水,求原混合气体中H2和CO的物质的量.
考点: 有关反应热的计算;用盖斯定律进行有关反应热的计算.
专题: 化学反应中的能量变化.
分析: 根据生成水的质量,利用2H2+O2═2H2O(l)可计算氢气的物质的量,再利用混合气体燃烧放出的热量与氢气燃烧放出的热量来计算CO燃烧放出的热量,最后利用热化学反应方程式来计算CO的物质的量.
解答: 解:水的物质的量为 =0.2mol,
=0.2mol,
由2H2+O2═2H2O可知,n(H2)=n(H2O)=0.2mol,
由2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ•mol﹣1可知,0.2molH2燃烧放出的热量为57.16KJ,
则CO燃烧放出的热量为113.74KJ﹣57.16KJ=56.58KJ,
设混合气体中CO的物质的量为x,则
CO(g)+ O2(g)=CO2(g)△H=﹣283kJ•mol﹣1 1 283KJ
O2(g)=CO2(g)△H=﹣283kJ•mol﹣1 1 283KJ
x 56.58KJ
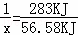 ,解得x=0.2mol,即n(CO)=0.20mol,
,解得x=0.2mol,即n(CO)=0.20mol,
答:原混合气体中H2和CO的物质的量均为0.2mol.
点评: 本题考查有关反应热的计算,明确物质的量与热量的正比例关系是解答的关键,难度不大,属于基础知识的考查.


科目:高中化学 来源: 题型:
实验室需要配制0.1mol•L﹣1 CuSO4溶液480mL.
按下列操作步骤填上适当的文字,以使整个操作完整.
(1)选择仪器.完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、 、 以及等质量的两片滤纸.
、 以及等质量的两片滤纸.
(2)计算,应选择下列正确
A.需要CuSO4固体8.0g B.需要CuSO4•5H2O晶体12.0g
C.需要CuSO4•5H2O晶体12.5g D.需要CuSO4固体7.7g
(3)称量.所用砝码生锈则所配溶液的浓度会偏高(填“偏高”、“偏低”或“无影响”).
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是 .
(5)转移、洗涤.在转移时应使用玻璃棒引流,需要洗涤烧杯2~3次是为了 .
(6)定容,摇匀.
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明配制的时间、溶液名称及浓度.
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶 液的浓度会 (填“偏高”、“偏低”或“无影响”).

查看答案和解析>>
科目:高中化学 来源: 题型:
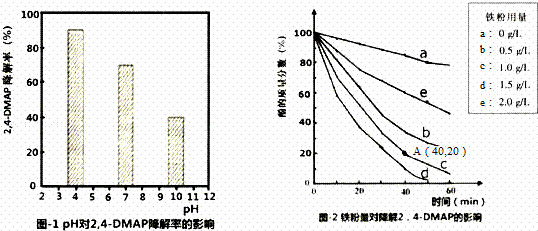
利用Na2S2O8产生的强氧化性SO4﹣•(自由基)降解有机污染物是目前最具潜力的高级氧化技术.文献报道某课题组探究pH,单质铁和Na2S2O8的浓度对降解2,4﹣DMAP(2,4﹣﹣甲基苯酚)效率的影响.
(1)探究溶液酸碱性的影响:将等量的2,4﹣DMAP加入到不同pH的Na2S2O8溶液中,结果如图1所示.由此可知:溶液酸性增强, (填“有利于”或“不利于”)Na2S2O8产生SO4﹣•.
(2)探究铁粉用量的影响:
①实验前,先用0.1mol•L﹣1 H2SO4洗涤Fe粉,其目的是 ,后用蒸馏水洗涤至中性;
②相同条件下,取不同量处理后的铁粉分别加入c(2,4﹣DMAP)=1.0×10 ﹣3mol•L﹣1、c(Na2S2O8)=4.2×10﹣3mol•L﹣1的混合溶液中,实验结果如图2所示.其中降解效率最好的铁粉用量是1.5g/L;计算从反应开始到A点时,2,4﹣DMAP降解的平均反应速率为 (忽略反应过程中溶液总质量变化).
③已知:2Fe+O2+2H2O=2Fe2++4OH﹣,S2O8﹣+Fe2+=SO4﹣+SO42﹣+Fe3+此外还可能会发生:SO4﹣+Fe2+=SO42﹣+Fe3+.当铁粉加入量过大时,2,4﹣DMAP的降解率反而下降,原因可能是(用离子方程式表示). .
(3)探究Na2S2O8浓度的影响:填写下表中空格,完成实验方案.
序号、物理量 M(Fe粉)/g V/mL V/mL 收集数据和得出结论
1 100 0.3 50 50
2 100V(污水)/mL 0.3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是()
A. Cu能与浓硝酸反应,而不与浓盐酸反应
B. Cu与浓硝酸反应比与稀硝酸反应快
C. N2与O2在常温、常压下不反应,放电时可反应
D. Fe与浓盐酸反应快,与稀盐酸反应慢
查看答案和解析>>
科目:高中化学 来源: 题型:
固体NH4Br置于密闭容器中,某温度下发生反应:NH4Br(s)⇌NH3(g)+HBr(g),2HBr(g)⇌Br2(g)+H2(g),2min后测知H2的浓度为0.5mol•L﹣1,HBr的浓度为4mol•L﹣1,若上述反应速率用v(NH3)表示,则下列速率正确的是()
A. 0.5mol•L﹣1•min﹣1 B. 2.5mol•L﹣1•min﹣1
C. 2mol•L﹣1•min﹣1 D. 1.25mol•L﹣1•min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是()
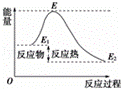
A. 反应物分子(或离子)间的每次碰撞是反应的先决条件
B. 反应物的分子的每次碰撞都能发生化学反应
C. 活化分子具有比普通分子更高的能量,催化剂能够减低活化能的数值
D. 活化能是活化分子的平均能量与所有分子平均能量之差,如图所示正反应的活化能为E﹣E1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于热化学反应的描述中正确的是()
A. HCl和NaOH反应的中和热△H=﹣5 7.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol
7.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol
B. 碳与二氧化碳的反应既是吸热反应,又是化合反应
C. 热化学方程式中化学计量数可表示分子个数
D. 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
真空碳热还原氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=akJ•mol﹣1
3AlCl(g)═2Al(l)+AlCl3(g)△H=bkJ•mol﹣1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=a+bkJ•mol﹣1(用含a、b的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室进行中和热测定的实验时除需要大烧杯(500mL)、小烧杯(100mL)外,所用的其他仪器和试剂均正确的一组是()
A. 0.50 mol•L﹣1盐酸,0.50 mol•L﹣1NaOH溶液,100 mL量筒1个
B. 0.50 mol•L﹣1盐酸,0.55 mol•L﹣1NaOH溶液,100 mL量筒2个
C. 0.50 mol•L﹣1盐酸,0.55 mol•L﹣1NaOH溶液,50 mL量筒1个
D. 0.50 mol•L﹣1盐酸,0.55 mol•L﹣1NaOH溶液,50 mL量筒2个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com