
(10分)生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与混合,在含有Zn、Cu等元素的催化剂条件下能合成一种生物质能——甲醇。
(1) 与CO互为等电子体的物质的化学式是 。
(2) CO2分子中碳原子的杂化类型是 杂化。
(3) 按电子排布Zn在元素周期表中属于 区,其晶体属于六方最密堆积,它的配位数是 。
(4) Cu的一种氯化物晶体的晶胞结构如右图所示(空心球代表氯离子),则一个晶胞中所含的数目是 。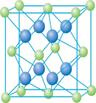
(1)N2
(2)sp
(3)ds 12
(4)4
【解析】
试题分析:(1) 等电子体:原子数相同,电子总数相同的分子,互称为等电子体。CO中的电子数为14个,原子个数为2;则N2可与其互称为等电子体。
(2)CO2分子的结构为O=C=O,含有双键,因此其杂化类型为sp杂化;
(3)Zn元素的电子排布为1s22s22p63s23p63d104s2 ,其价电子层为3d104s2,因此属于ds区。因其价电子层上有12个电子,当其晶体属于六方最密堆积,它的配位数是12.
考点:物质的结构
点评:本题是对物质结构的考查。对于此类题型的解答,应从物质的结构入手。另外,对于等电子体的概念,一定要具有相同的原子个数。


科目:高中化学 来源: 题型:
水煤气是重要
燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g) ![]() CO (g) +H2 (g) △H= +131.3 kJ•mol-1
CO (g) +H2 (g) △H= +131.3 kJ•mol-1
(1)实际工业生产中,向炭层间隔交替通入水蒸气和空气,其原因是 。
(2)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
| 容器编号 | c(H2O)/mol·L-1 | c(CO)/mol·L-1 | c(H2)/mol·L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | ________ | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正____ν逆 |
(3)生物乙醇可由淀粉或纤维素等生物质原料发酵获得。利用乙醇可进而获得合成气(CO、H2)。
用乙醇生产合成气有如下两条路线:
a、水蒸气催化重整:CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g)
b、部分催化氧化:CH3CH2OH(g)+1/2O2(g)→3H2(g)+2CO(g)
某生物质能研究所准备利用乙醇得到的合成气合成一种生物汽油。乙醇各分一半按a、b两式反应。合成气合成生物汽油的反应为:2mCO+(2m+n)H2→2CmHn+2mH2O。假定合成的生物汽油中含有X、Y两种成分,且X、Y都是有8个碳原子的烃,X是苯的同系物,Y是烷烃。
①X的分子式为 ,Y的分子式为 。
②50吨质量分数为92%的乙醇经上述转化(假定各步转化率均为100%),则最终可获得X的质量为多少吨?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com