

科目:高中化学 来源:不详 题型:填空题

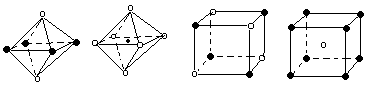
| A.① | B.② | C.③ | D.④ |
| 分子或离子 | H2S | SnCl62- | PH3 | ClO4-- |
| 空间构型 | | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.量筒 | B.烧杯 | C.容量瓶 | D.试管 |
|
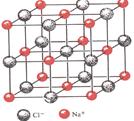
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
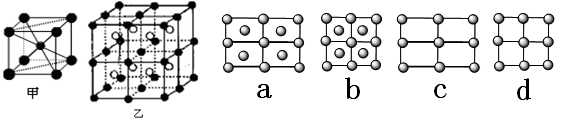
 原子周围距离最近的
原子周围距离最近的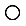 原子有 个。
原子有 个。
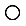 表示C原子,
表示C原子, 表示镁原子
表示镁原子 =1.414)CXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为4.28×10-10m。晶胞中两个C原子之间的最短距离为___________m(精确至0.01)。若晶体中的C分别为C2﹢、C3﹢,此晶体中C2﹢与C3﹢的最简整数比为_________。
=1.414)CXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为4.28×10-10m。晶胞中两个C原子之间的最短距离为___________m(精确至0.01)。若晶体中的C分别为C2﹢、C3﹢,此晶体中C2﹢与C3﹢的最简整数比为_________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子 |
| B.在NaCl晶体中每个Na+(或Cl-)周围都紧邻6个Cl-(或6个Na+) |
| C.白磷晶体中,粒子之间通过共价键结合,键角为60° |
| D.离子晶体在熔化时,离子键被破坏;而分子晶体熔化时,化学键不被破坏 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金刚石晶体中,碳原子数与C—C键数之比为1:2 |
B.720g C60晶体含有NA个如图中晶胞单元 |
| C.离子晶体中每个离子周围均吸引着6个带相反电荷的离子 |
| D.Cu的堆积方式是面心立方最密堆积,配位数是8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
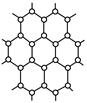
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com