
分析 将一定量SO2通入含6mol NaOH的溶液,完全反应后,再加入过量Na2CO3,加热放出2mol CO2,说明是NaO3与Na2CO3反应,则NaOH完全反应,最终S元素全部以Na2SO3形式存在,根据钠离子守恒计算最终生成Na2SO3的物质的量,进而计算其质量.
解答 解:将一定量SO2通入含6mol NaOH的溶液,完全反应后,再加入过量Na2CO3,加热放出2mol CO2,说明是NaO3与Na2CO3反应,则NaOH完全反应,由碳元素守恒可知参加反应的Na2CO3为2mol,最终S元素全部以Na2SO3形式存在,根据钠离子守恒,最终生成n(Na2SO3)=n(Na2CO3)+$\frac{1}{2}$n(NaOH)=2mol+$\frac{1}{2}$×6mol=5mol,其质量为5mol×126g/mol=630g,
答:最终生成Na2SO3的质量为630g.
点评 本题考查混合物有关计算,关键是理解生成二氧化碳的反应判断NaOH完全反应,注意利用守恒法计算解答,较好地考查学生分析计算能力.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、H+ | |
| B. | 酸性溶液中可能大量存在Na+、ClO?、SO42?、I? | |
| C. | 碱性溶液中可能大量存在Na+、K+、Cl?、HCO3? | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl?、I? |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
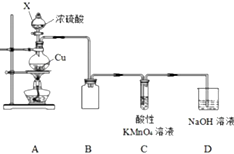 某化学兴趣小组探究铜与浓硫酸的反应,探究过程如下.
某化学兴趣小组探究铜与浓硫酸的反应,探究过程如下.| 实验步骤 | 现象 | 结论 |
| 取灰色固体于烧杯中,加入蒸馏水,搅拌、过滤,洗涤滤渣 | 固体部分溶解,溶液呈蓝色 | 灰色固体中含有CuSO4 |
| 将滤渣转移到另一烧杯中,加入足量稀硫酸,搅拌,充分反应后过滤,将滤渣洗涤、干燥 | 固体部分溶解,滤液呈蓝色,滤渣为黑色 | 灰色固体中含有CuO |
| 称量上一步得到的黑色滤渣2.56g,在空气中灼烧至恒重,冷却、称量 | 得到2.40g固体 | 灰色固体中含有Cu2S、CuS |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
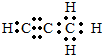 .Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.
.Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
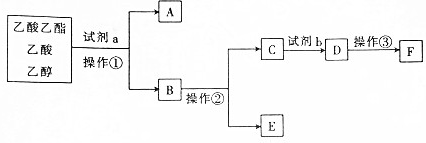
| A. | 操作②是蒸馏 | |
| B. | 试剂a可能是饱和碳酸钠溶液 | |
| C. | 试剂b比同浓度的D溶液酸性强 | |
| D. | A与E在浓硫酸加热的条件下可生成乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素均可与氢元素形成 18电子分子 | |
| B. | X、Y、Z、W形成的单质最多有 6种 | |
| C. | 四种元素中,Z的最高价氧化物对应水化物酸性最强 | |
| D. | 四种元素的原子半径:rZ>rX>rY>rW |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com