
高锰酸钾是强氧化剂,它的用途遍布各个行业。
(1)工业上由软锰矿(主要成分为MnO2)生产髙锰酸钾分为两个步骤。
①步骤一将软锰矿与过量的固体KOH和空气在高温下反应,生成锰酸钾(K2MnO4),该反应的化学方程式是______________。
②步骤二以石墨为阳极,铁为阴极,电解锰酸钾(K2MnO4)溶液,在_______ (填“阴极区”或“阳极区”)得到高锰酸钾。阴极反应的化学方程式是_______。
(2)某研究小组用工业生产高锰酸钾产生的废渣——猛泥(含K2MnO4、MnO2及Pb、Ca等元素)和乳钢废酸液制取工业级碳酸锰(MnCO3),其流程如下:
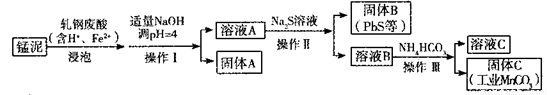
③轧钢废酸中Fe2+的作用是______________。
④操作I、操作II、操作III的名称是_______。
⑤溶液C中除含有Ca2+、Mn2+、H+外,还含有的阳离子是_______。
⑥若固体C中不含CaCO3,则溶液D中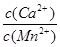 <_______。
<_______。
[已知:Ksp(MnCO3)=1×10—11,Ksp(CaCO3)=5×10—9]
(16分)(1)① 2MnO2+4KOH+O2  2K2MnO4+2H2O(3分)
2K2MnO4+2H2O(3分)
② 阳极区(2分) 2H2O+2e—=H2↑+2OH—(3分)(2H+ + 2e—= H2↑也给3分)
(2)③ 将高价的锰元素还原成Mn2+(2分)
④ 过滤(2分)
⑤ K+、Na+、NH4+(2分)
⑥ 500(2分)
【解析】
试题分析:(1)①根据题意,锰元素的化合价由+4升高为+6,由此推断氧化剂为空气中的氧气,根据化合价升降总数相等、原子守恒推断,该反应式为2MnO2+4KOH+O2  2K2MnO4+2H2O;②锰元素的化合价由+6升为+7,发生氧化反应,根据电解原理推断,该反应在阳极区发生;电解质溶液中的H+、K+移向阴极,氧化性较强的H+在阴极发生还原反应,即2H++2e—=H2↑或2H2O+2e—=H2↑+2OH—;(2)③④⑤根据工艺流程图的目标产物逆推可知,锰元素的化合价由+6降为+2,需要加入合适的还原剂,轧钢废酸中Fe2+可以将锰泥中的MnO4—还原为Mn2+,Fe2+被MnO4—氧化为Fe3+,调节溶液pH至4时,Fe3+完全变为Fe(OH)3沉淀,则操作I为过滤,溶液A的主要成分为Mn2+、Fe2+、Pb2+、Ca2+、H+等,固体A的成分为Fe(OH)3;Na2S溶液能除去Fe2+、Pb2+、H+等,分别生成FeS、PbS沉淀和H2S气体等,则操作II为过滤,溶液B的主要成分为Mn2+、Ca2+、S2—、Na+等;Na2S是盐,水解导致其溶液呈碱性,NH4HCO3在碱性条件下变为NH4+、CO32—,由于Ksp(MnCO3)<Ksp(CaCO3),CO32—与Mn2+、Ca2+混合时优先生成MnCO3沉淀,则操作III为过滤,根据离子共存推断,溶液C中主要阳离子为Mn2+、Ca2+、H+、Na+、NH4+;⑥依题意,CaCO3(s)+Mn2+(aq)
2K2MnO4+2H2O;②锰元素的化合价由+6升为+7,发生氧化反应,根据电解原理推断,该反应在阳极区发生;电解质溶液中的H+、K+移向阴极,氧化性较强的H+在阴极发生还原反应,即2H++2e—=H2↑或2H2O+2e—=H2↑+2OH—;(2)③④⑤根据工艺流程图的目标产物逆推可知,锰元素的化合价由+6降为+2,需要加入合适的还原剂,轧钢废酸中Fe2+可以将锰泥中的MnO4—还原为Mn2+,Fe2+被MnO4—氧化为Fe3+,调节溶液pH至4时,Fe3+完全变为Fe(OH)3沉淀,则操作I为过滤,溶液A的主要成分为Mn2+、Fe2+、Pb2+、Ca2+、H+等,固体A的成分为Fe(OH)3;Na2S溶液能除去Fe2+、Pb2+、H+等,分别生成FeS、PbS沉淀和H2S气体等,则操作II为过滤,溶液B的主要成分为Mn2+、Ca2+、S2—、Na+等;Na2S是盐,水解导致其溶液呈碱性,NH4HCO3在碱性条件下变为NH4+、CO32—,由于Ksp(MnCO3)<Ksp(CaCO3),CO32—与Mn2+、Ca2+混合时优先生成MnCO3沉淀,则操作III为过滤,根据离子共存推断,溶液C中主要阳离子为Mn2+、Ca2+、H+、Na+、NH4+;⑥依题意,CaCO3(s)+Mn2+(aq) MnCO3(s)+Ca2+(aq),该反应的平衡常数K=
MnCO3(s)+Ca2+(aq),该反应的平衡常数K=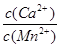 =
=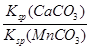 =
=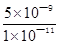 =500。
=500。
考点:考查氧化还原反应方程式的配平、电解原理、物质制备工艺流程、混合物的分离与提纯、离子共存、难溶电解质的溶解平衡、沉淀的转化、溶度积的应用等相关知识。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| a |
| 10 |
| 1.45 |
| a |
| 1.45 |
| a |
| 1.40 |
| a |
| 1.40 |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| a |
| 10 |
| 1.45 |
| a |
| 1.45 |
| a |
| 1.40 |
| a |
| 1.40 |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| CuCl2 | ||
|
| CuCl2 | ||
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com