
【题目】下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:

(1)非金属性最强的是___(填元素名称),化学性质最不活泼的是____(填元素符号)。
(2)元素①-⑩中半径最大的元素是____(填元素符号)
(3)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是________。(填化学式)
(4)表中能形成两性氢氧化物的元素是______(填元素符号)
【答案】氟 Ar Na HClO4>HNO3>H2CO3 Al
【解析】
根据元素在周期表的位置,可推出①-⑩元素分别是H、C、N、O、F、Na、Al、S、Cl、Ar,然后根据元素周期律分析判断。
根据上述分析可知①-⑩元素分别是H、C、N、O、F、Na、Al、S、Cl、Ar。
(1)由于同一周期的元素随原子序数的增大,元素的非金属性逐渐增强;同一主族的元素,随原子核外电子层数的增多,元素的非金属性逐渐减弱,所以上述10种元素中非金属性最强的元素是氟元素;惰性气体原子最外层达到8个(He是K层的2个电子)的稳定结构,因此化学性质最不活泼的是⑩号的Ar元素;
(2)由于同一周期的元素随原子序数的增大,元素的原子半径逐渐减小;同一主族的元素,随原子序数的增大而增大,所以元素①-⑩中半径最大的元素是Na元素;
(3)②表示的是C元素;③表示的是N元素;⑨表示的是Cl元素,三种元素的最高价含氧酸分别是H2CO3、HNO3、HClO4,H2CO3是二元弱酸;HNO3是一元强酸;HClO4是所有酸中酸性最强的一种,因此这三种酸的酸性由强到弱的顺序是HClO4>HNO3>H2CO3;
(4)⑦号表示的Al元素处于金属与非金属交界处,其氢氧化物Al(OH)3是两性氢氧化物,可以与强酸、强碱发生反应产生盐和水。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化石燃料开采、加工过程产生的H2S废气可以通过多种方法进行治理.可以制取氢气,同时回收硫单质,既廉价又环保。回答下列问题:
(1)已知:2H2(g)+O2(g)=2H2O(g) △H1
S(s)+ O2(g)=SO2(g) △H2
2S(s)![]() S2(g) △H3
S2(g) △H3
2H2S(g)+SO2(g)=3S(s)+2H2O(g) △H4
则反应2H2S(g)![]() 2H2(g)+ S2(g)的△H=_____
2H2(g)+ S2(g)的△H=_____
(2)工业上采州高温热分解HzS的方法制取H2,在膜反应器中分离出H2。
在恒容密闭容器中,阻H2S的起始浓度均为0.009 mol/L控制不同温度进行H2S分解:![]() ,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度F反应经过相同时间时H2S的转化率。
,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度F反应经过相同时间时H2S的转化率。
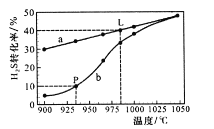
①在935℃时,该反应经过t s H2S的转化率达到P点数值,则在ts内用H2浓度变化表示的平均反应速率v(H2)=________。
②温度升高,平衡向____方向移动(填“正反应”“逆反应”),平衡常数____(填“增大”“减小”或“不变”)。985℃时该反应的平衡常数为________。
③随着H2S分解温度的升高,曲线b逐渐向曲线a靠近,其原因是___________。
(3)电解法治理硫化氢是先用FeCl3溶液吸收含H2S的工业废气,所得溶液用惰性电极电解,阳极区所得溶液循环利用。

①进入电解池的溶液中,溶质是____。
②阳极的电极反应式为________________。
③电解总反应的离子方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水中存在多种分子和离子,它们在不同的反应中表现出不同的性质。下列结论正确的是( )
A. 加入有色布条,片刻后有色布条褪色,说明有Cl2存在
B. 溶液呈浅黄绿色,且有刺激性气味,说明有Cl2存在
C. 先加入盐酸酸化,再加入AgNO3溶液,生成白色沉淀,说明有Cl-存在
D. 加入NaOH溶液,氯水的浅黄绿色消失,说明有HClO存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2.0 L的密闭容器内,物质D在T ℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是
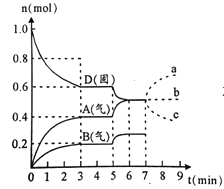
A. 从反应开始到第一次达到平衡时,A物质的平均反应速率为0.0667 mol/(L·min)
B. 该反应的化学方程式为2D(s) 2A(g)+B(g),该反应的平衡常数表达式为K=c(A)2·c(B)
C. 已知:反应的H>0,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度
D. 若在第7分钟时增加D的物质的量,则表示A的物质的量变化正确的是a曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种常见的非金属单质,B是氧化物,E是A的氢化物,D是A的最高价氧化物对应的水化物,上述物质间转化关系如图所示。下列说法错误的是 ( )

A. 若E、D的水溶液均呈酸性,则A为硫
B. 若D是一种难溶于水的物质,则A为硅
C. 若E、D的水溶液均呈酸性,则B能与水反应
D. 若D是一种难溶于水的物质,则B能与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A~J分别代表相关反应的一种物质。已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出。
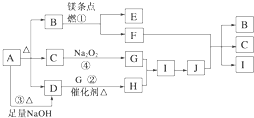
请填写以下空白:
(1)A的化学式________;B的结构式________;D的电子式________;
(2)写出反应①②的化学方程式:
①________________________________________________,
②_________________________________________。
(3)写出反应③的离子方程式:________________________________________。
(4)J与F反应的化学方程式: _________________________________________。
(5)在反应④中,当生成标况下3.36 L G时,转移电子数为__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Na2O2投入FeCl3溶液中,对观察到的现象描述准确的是 ( )
A.生成白色沉淀
B.既有气泡产生,又生成红褐色沉淀
C.既有气泡产生,又生成白色沉淀
D.有气泡产生,无沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:

回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式__________________________________。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是_________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃分子中有40个电子,它燃烧时生成等体积的CO2和H2O(g),该有机物的分子式为 ( )
A.C4H8
B.C4H10
C.C5H10
D.C5H12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com