
【题目】“雾霾”成为人们越来越关心的环境问题。雾霾中含有二氧化硫、氮氧化物和可吸入颗粒物等污染性物质。请回答下列问题:
(1)汽车尾气是雾霾形成的原因之一。尾气治理可用汽油中挥发出来的烃类物质(CxHy)催化还原尾气中的NO气体,该过程的化学方程式为___________________。
(2)冬季燃煤供暖产生的废气也是雾霾的主要来源之一。经研究发现将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH
N2(g)+2CO2(g) ΔH
已知:①N2(g)+O2(g)![]() 2NO(g) ΔH1=+180.5 kJ·mol-1
2NO(g) ΔH1=+180.5 kJ·mol-1
②2CO(g)![]() 2C(s)+O2(g) ΔH2=+221 kJ·mol-1
2C(s)+O2(g) ΔH2=+221 kJ·mol-1
③C(s)+O2(g)![]() CO2(g) ΔH3=-393.5 kJ·mol-1
CO2(g) ΔH3=-393.5 kJ·mol-1
则ΔH=_____________。
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图一所示,电极材料为石墨。
①a表示_____离子交换膜(填“阴”或“阳”)。A~E分别代表生产中的原料或产品,其中C为硫酸,则A表示_________,E表示___________。
②阳极的电极反应式为___________________________。
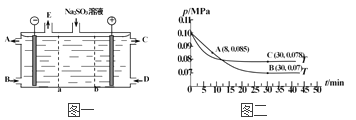
(4)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)![]() 2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2) ∶n(O2)=2∶1],测得容器内总压强与反应时间如图二所示。
2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2) ∶n(O2)=2∶1],测得容器内总压强与反应时间如图二所示。
①图中A点时,SO2的转化率为____________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率vc(正)与A点的逆反应速率vA(逆)的大小关系为vc(正)______vA(逆)(填“>”、“<”或“=”)。
③图中B点的压强平衡常数Kp=_______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】 4CxHy+(8x+2y) NO=== 4x CO2+(4x+y) N2+2y H2O -746.5 kJ·mol-1 阳 NaOH溶液 氢气 SO32-―2e-+H2O=2H++SO42- 45% > 24300 (MPa)-1
【解析】(1)烃类物质(CxHy)催化还原尾气中的NO气体,可以得到无毒的气体氮气和二氧化碳,即4CxHy+(8x+2y) NO= 4x CO2+(4x+y) N2+2y H2O;(2)已知:①N2(g)+O2(g)![]() 2NO(g) ΔH1=+180.5 kJ·mol-1,②2CO(g)
2NO(g) ΔH1=+180.5 kJ·mol-1,②2CO(g)![]() 2C(s)+O2(g) ΔH2=+221 kJ·mol-1,③C(s)+O2(g)
2C(s)+O2(g) ΔH2=+221 kJ·mol-1,③C(s)+O2(g)![]() CO2(g) ΔH3=-393.5 kJ·mol-1,根据盖斯定律,由②+③×2-①得到2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH =ΔH2×2+ΔH3×2-ΔH1=+221 kJ·mol-1+2(-393.5kJmol-1)-(+180.5kJmol-1)=-746.5kJmol-1;(3)①左边连接电源负极是电解池的阴极,阴极反应式为,促进了水的电离,该极附近溶液碱性增强,生成NaOH,A为NaOH溶液,E为H2,a为阳离子交换膜;②阳极发生氧化反应,且生成产物为硫酸,则阳极反应式为:SO32-―2e-+H2O=2H++SO42-;
CO2(g) ΔH3=-393.5 kJ·mol-1,根据盖斯定律,由②+③×2-①得到2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH =ΔH2×2+ΔH3×2-ΔH1=+221 kJ·mol-1+2(-393.5kJmol-1)-(+180.5kJmol-1)=-746.5kJmol-1;(3)①左边连接电源负极是电解池的阴极,阴极反应式为,促进了水的电离,该极附近溶液碱性增强,生成NaOH,A为NaOH溶液,E为H2,a为阳离子交换膜;②阳极发生氧化反应,且生成产物为硫酸,则阳极反应式为:SO32-―2e-+H2O=2H++SO42-;
(4)①依据化学三行列式计算,设氧气消耗物质的量为x,
2SO2(g)+O2(g)2SO3(g)
起始量(mol) 2a a 0
变化量(mol) 2x x 2x
平衡量(mol) 2a-2x a-x 2x
图中A点时,气体物质的量0.085,则![]() =
=![]() ,x=0.45a,
,x=0.45a,
SO2的转化率=![]() ×100%=45%;
×100%=45%;
②图象分析可知, C点是平衡状态,A点反应未达到平衡状态,其中C点的正反应速率vC(正)与A点的逆反应速率vA(逆)的大小关系为vC(正)>vA(逆);③图中B点,依据化学三段式计算,设氧气消耗物质的量为y,
2SO2(g)+O2(g)2SO3(g)
起始量(mol) 2a a 0
变化量(mol) 2y y 2y
平衡量(mol)2a-2y a-y 2y
B点气体物质的量为 0.007,则![]() =
=![]() ,y=0.9a,
,y=0.9a,
平衡常数K= =24300(MPa)-1。
=24300(MPa)-1。


科目:高中化学 来源: 题型:
【题目】已知利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇的主要反应如下:
①CO(g)+2H2(g) ![]() CH3OH(g) ΔH1<0
CH3OH(g) ΔH1<0
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2<0
CH3OH(g)+H2O(g) ΔH2<0
③CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH3>0
CO(g)+H2O(g) ΔH3>0
回答下列问题:
(1)反应①的化学平衡常数K表达式为___________________;图1中能正确反映平衡常数K随温度变化关系的曲线为_______(填曲线标记字母),其判断理由是______________________。
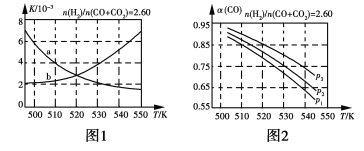
(2)合成气组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而___________(填“增大”或“减小”),其原因是___________________;图2中的压强由大到小为_________________________,其判断理由是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方案不能达到实验目的的是( )
A.用闻气味的方法鉴别CO2和CO
B.用pH试纸鉴别NaCl溶液与HCl溶液
C.用品红溶液鉴别SO2和CO2
D.用激光笔照射的方法鉴别溶液和胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究HClO的漂白性,某同学设计如下的实验: 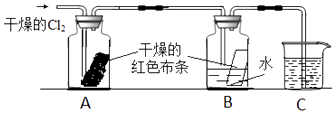
(1)通入氯气后,从集气瓶A中干燥的红色布条的现象可得出的结论是;从集气瓶B中湿润的红色布条的现象可得出的结论是 , 其中氯气发生反应的化学方程式为 .
(2)烧杯中所盛的试剂为 , 其作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 氯化钙溶液中通入CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+
B. 以石墨作电极电解氯化铝溶液:2Cl–+2H2O电解2OH–+H2↑+Cl2↑
C. 200 mL 2 mol/L的FeBr2溶液中通入11.2 L标准状况下的氯气:4Fe2++6Br–+5Cl2=4Fe3++3Br2+10Cl–
D. 向明矾溶液中加人氢氧化钡溶液至沉淀的物质的量最大:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题
(1)NaHSO4与NaHCO3溶液反应离子方程式 .
(2)KClO3+6HCl═KCl+3Cl2↑+3H2O ①氧化剂与还原剂的物质的量的比为 .
②氧化产物与还原产物的物质的量的比 .
(3)已知下面三个反应:2Fe2++Cl2=2Fe3++2Cl﹣;2Fe2++Br2═2Fe3++2Br﹣; 2Br﹣+Cl2═Br2+2Cl﹣①根据以上三个反应,判断还原剂的还原性由强到弱的顺
②写出氯气和溴化亚铁以物质的量之比为3:4的离子反应方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com