
下列说法正确的是( )
A.c(H+):c(OH-)=1:10-2的溶液中K+、Ba2+、ClO-、CO32-一定能大量存在
B.室温下,水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在
C.相同温度下,等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小关系为②>④>③>①
D.往0.1mol/LCH3COOH溶液中通入少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中c(CH3COOH)/c(H+)·c(CH3COO-) 增大
科目:高中化学 来源:2016届山东省高三上学期12月质检化学试卷(解析版) 题型:选择题
分别依据下列实验事实,得出的结论正确的是
实验事实 | 结论 | |
A | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 | 随溶液pH减小,“84”消毒液的氧化能力增强 |
B | 苯酚和水的浊液中,加碳酸钠溶液,溶液变澄清 | 苯酚的酸性比碳酸强 |
C | 铜放入稀硫酸中,无明显现象,再加入硝酸钠固体,溶液变蓝,有明显的气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
D | 向1mL 0.1mol/L的硝酸银溶液中加入1mL0.1mol/LNaCl溶液,出现白色沉淀,再加入几滴0.1mol/L NaBr溶液,有淡黄色沉淀生成 | 氯化银的溶解度小于溴化银 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上期中(理)化学试卷(解析版) 题型:选择题
在室温下等体积的酸和碱的混合溶液,混合后pH值一定小于7的是
A.pH=3的硝酸跟pH=11的氢氧化钾溶液
B.pH=3的盐酸跟pH=11的氨水
C.pH=3的醋酸跟pH=11的氢氧化钡溶液
D.pH=3的硫酸跟pH=11的氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是

A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)= c(A—)+ c(HA)
D.b点所示溶液中c(A—)> c(HA)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一上12月月考化学试卷(解析版) 题型:选择题
下列药品久置空气中,溶液中溶质的种类和数量几乎没有变化的是
A.NaOH溶液 B.H2SO3溶液 C.浓硝酸 D.浓硫酸
查看答案和解析>>
科目:高中化学 来源:2016届浙江绍兴市高三上学期期中考试化学试卷(解析版) 题型:选择题
铋(Bi)位于元素周期表中ⅤA族,+3价较稳定,铋酸钠(NaBiO3)溶液呈无色。取一定量的硫酸锰(MnSO4)溶液依次滴加下列溶液,对应的现象如下表所示:
加入溶液 | ①适量的铋酸钠溶液 | ②过量的双氧水 | ③适量KI?淀粉溶液 |
实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变成蓝色 |
关于NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱(从左至右)的顺序为
A.NaBiO3、KMnO4、H2O2、I2
B.I2、H2O2、KMnO4、NaBiO3
C.KMnO4、NaBiO3、I2、H2O2
D.H2O2、I2、NaBiO3、KMnO4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高一上期中测试化学试卷(解析版) 题型:选择题
关于下列说法错误的是( )
A.除去CO2中混有的HCl,可将气体通过足量碳酸钠溶液
B.锌粒投入稀硫酸中,发生的离子反应是:Zn+2H+=Zn2++H2↑
C.除去胶体中的少量离子,可以用渗析的方法
D.室温下,等浓度的盐酸和醋酸,前者的导电性更强
查看答案和解析>>
科目:高中化学 来源:2016届江西师大附中,九江一中高三上期中化学试卷(解析版) 题型:实验题
草酸钴用途广泛,可用于指示剂和催化剂的制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
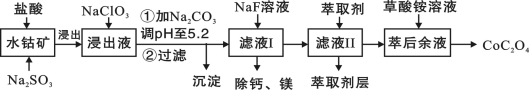
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将_____________还原(填离子符号)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价。该反应的离子方程式为____________。
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是_________;使用萃取剂适宜的pH是______。
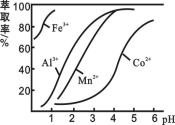
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)= 。
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:选择题
用脱脂棉包住约0.2gNa2O2粉末,投入盛满CO2的集气瓶中,棉花燃烧,此实验不能得出的结论是
A.CO2在一定条件下可以支持燃烧 B.该反应是一个放热反应
C.该实验的反应中有O2生成 D.Na2O2可作为呼吸面具中氧气来源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com