
下列图示与对应的叙述不相符的是
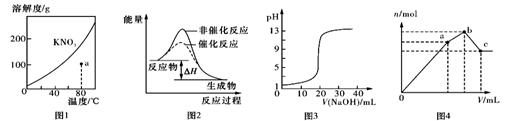
A.图1表示KNO3的溶解度曲线,a点所示的溶液是80℃时KNO3不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示0.1000mol/LNaOH滴定20.00 mL 0.1000mol/L醋酸的滴定曲线
D.图4表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,体积V与沉淀n的变化
科目:高中化学 来源: 题型:
下列说法正确的是
A.需要通电才可进行的有:电解、电泳、电离、电镀、电化腐蚀
B.在Fe(OH)3胶体中滴加稀硫酸的现象为:先沉淀后溶解
C.用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水)===Fe(OH)3↓+3H+
D.在Fe(OH)3胶体中插入两电极通电,在阳极附近颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
用高铁酸钠(Na2FeO4)对河、湖水消毒是城市饮用水处理的新技术,已知反应
Fe2O3+3Na2O2=2Na2FeO4+Na2O,下列说法正确的是
A.Na2O2既是氧化剂又是还原剂 B.Fe2O3在反应中显氧化性
C.3 mol Na2O2发生反应,有12 mol电子转移
D.Na2FeO4能消毒杀菌是因其具有强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关热化学方程式的叙述正确的是
A.反应物的总能量低于生成物的总能量时,该反应必须加热才能发生
B.2H2(g)+O2(g)=2H2O(l);△H1=-akJ·mol-1,则氢气燃烧热为akJ·mol-1
C.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-akJ·mol-1,则中和热为a/2kJ·mol-1
D.N2(g)+3H2(g)=2NH3(g);△H=-akJ·mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
已知FeS与某浓度的HNO3反应时生成Fe(NO3)3、H2SO4和某一单一的还原产物,若FeS和参与反应的HNO3的物质的量之比为16,则该反应的还原产物是
A.NO B.NO2 C.N2O D.NH4NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
“火星快车”号和“金星快车”号探测器分别在火星和金星大气层中发现了一种非常特殊的气态化合物。这种化合物的存在不但会导致金星上的温室效应被成倍的放大,而且可能会在火星上也诱发温室效应的产生。它的结构式为16O==C==18O。下列说法正确的是( )
A.16O与18O为同种原子 B.16O==C==18O与16O==C==16O互为同位素
C.16O==C==18O与16O==C==16O的化学性质几乎相同
D.16O==C==18O与NaO2反应生成的氧气中含18O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知甲酸(HCOOH)和乙酸为同系物。在实验室里常用甲酸在浓硫酸的作用下制取少量一氧化碳,现用甲酸与乙醇反应制取甲酸乙酯来验证甲酸具有能发生酯化反应的性质,装置如下图所示。回答下列问题:
(1)生成甲酸乙酯反应的化学方程式为___________________。
若甲酸分子中的氧都是18O,乙醇分子中的氧是16O,则两者在浓硫酸作用
下反应一段时间后,有 种分子含有18O。
|
(3)长导管b的作用是_____________。在实验过程中导管b______(填“能”或“不能”)直接与大气相通。
(4)制得的甲酸乙酯中常含有杂质,通常可用 (填一种试剂的名称)把甲酸乙酯分离出,过程中应采用的实验操作是 (填操作名称),用到的主要玻璃仪器为 。
(5)生成甲酸乙酯的反应是可逆反应,下列描述能说明乙醇与甲酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol甲酸乙酯,同时生成1mol甲酸
②单位时间里,生成1mol甲酸乙酯,同时生成1mol水
③混合物中各物质的浓度不再变化
④正反应的速率与逆反应的速率相等
⑤单位时间里,消耗1mol乙醇,同时消耗1mol甲酸

查看答案和解析>>
科目:高中化学 来源: 题型:
氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:

 (1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
 (用a、b 表示)。
(用a、b 表示)。
 (2)负极反应式为 。
(2)负极反应式为 。
 (3)电极表面镀铂粉的原因为 。
(3)电极表面镀铂粉的原因为 。
 (4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
 Ⅰ.2Li+H2
Ⅰ.2Li+H2 LiH
LiH Ⅱ.LiH+H2O==LiOH+H2↑
Ⅱ.LiH+H2O==LiOH+H2↑
 ①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
 ②已知LiH固体密度为0.82 g/cm3。用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
②已知LiH固体密度为0.82 g/cm3。用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
 ③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com