
| A. | 碳的燃烧热大于110.5 kJ/mol | |
| B. | ①反应的焓变为-221 kJ/mol | |
| C. | 稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
分析 A、CO燃烧生成二氧化碳继续放出热量;
B、反应热包含符号,①的反应热为-221 kJ•mol-1;
C、中和热为57.3kJ•mol-1;
D、醋酸是弱电解质,电离需吸收热量.
解答 解:A、由2C(s)+O2(g)═2CO(g)△H=-221kJ/mol 可知,1mol碳燃烧生成CO放出的热量为110.5 kJ,CO燃烧生成二氧化碳继续放出热量,故1mol碳完全燃烧放出的热量大于110.5 kJ,所以碳的燃烧热大于110.5 kJ/mol,故A正确;
B、反应热包含符号,①的反应热为-221 kJ•mol-1,故B正确;
C、中和热为放热反应,则叙述中和热时不用“-”,即稀硫酸与稀NaOH溶液反应的中和热为57.3kJ•mol-1,故C错误;
D、醋酸是弱电解质,电离需吸收热量,稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量小于57.3 kJ,故D错误;
故选:AB.
点评 本题考查学生对于反应热、中和热的理解及有关计算等,难度不大,注意稀的强酸、强碱的中和热为△H=-57.3kJ/mol.


科目:高中化学 来源: 题型:实验题
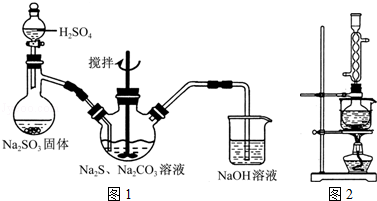
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是放热反应都是自发的,吸热反应都是非自发的 | |
| B. | 常温下,C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0 | |
| C. | 任何能使熵值增大的过程都能自发进行 | |
| D. | 反应物和生成物所具有的总焓决定了反应是否能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入BaCl2溶液产生不溶于稀HNO3的白色沉淀,说明原溶液中有SO42- | |
| B. | 加入盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-存在 | |
| C. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| D. | 加入NaOH溶液有白色沉淀出现,则原溶液中一定含有Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸盐与盐酸之间的反应 | B. | 一切碳酸盐与一切酸之间的反应 | ||
| C. | 可溶性碳酸盐与强酸之间的反应 | D. | 可溶性碳酸盐与一切酸之间的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,5v正(O2)=4v逆(NO) | |
| B. | 若单位时间内生成x mol NO,同时消耗x mol NH3,则可确定反应达到平衡状态 | |
| C. | 达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率也减小 | |
| D. | 化学反应速率的关系是2v正(NH3)=3v正(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 多余的氯气可以用氢氧化钠溶液吸收 | |
| B. | 用澄清的石灰石可以鉴别CO2和SO2 | |
| C. | SO2、Cl2都能使品红溶液褪色,其原理不同 | |
| D. | 铁丝在氯气中燃烧生成三价铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
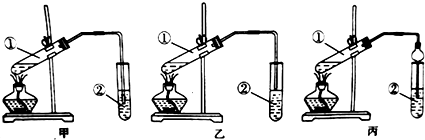
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com