
下列离子方程式表达正确的是
科目:高中化学 来源: 题型:单选题
已知Br2+2Fe2+=2Fe3++2 Br –,当向含1mol FeBr2溶液中逐渐通入Cl2,溶液中有一半的Br –被氧化时,下列判断不正确的是( )
| A.反应前后溶液的颜色发生了改变 |
| B.反应后溶液中c(Cl - )="c(Br" -) |
| C.参加反应的Cl2为1 mol |
| D.反应的离子方程式为:2Fe2++2 Br –+2Cl2=2Fe3++Br2+4Cl– |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温时向某溶液中滴入石蕊试液,溶液呈蓝色,其中可能大量共存的离子是
| A.Ag(NH3)2+、K+、Cl-、OH- | B.S2-、Na+、Cl-、ClO- |
| C.Al3+、K+、SO32-、S2- | D.Fe3+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列相关反应的离子方程式书写正确的是
| A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+ = Fe3++3H2O |
| B.硫酸铜溶液显酸性:Cu2+ + 2H2O = Cu(OH)2↓+ 2H+ |
C.向碳酸氢铵溶液中加过量石灰水并加热:NH+ 4+OH-  NH3↑+H2O NH3↑+H2O |
| D.用酸化的高锰酸钾溶液氧化双氧水:2MnO- 4+6H++5H2O2 = 2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某工业废水含有下列离子中的5种(不考虑水的电离及离子的水解),K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,且各种离子的物质的量浓度相等。甲同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰。
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
③另取溶液加入BaCl2溶液,有白色沉淀生成。
根据上述实验,以下推测正确的是( )
| A.溶液中难以确定Al3+的存在与否 |
| B.原溶液中所含的离子为:Cu2+、Fe2+、Cl-、NO3-、SO42- |
| C.步骤②中可以确定Fe2+、NO3-的存在,不能确定其它离子的存在 |
| D.步骤③中的白色沉淀为2种钡盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应的离子方程式书写正确的是:
| A.用硫氰化钾溶液检验Fe3+:Fe3++3SCN- = Fe(SCN)3↓ |
| B.向海带灰浸出液中加入稀硫酸、双氧水:2I- + 2H+ + H2O2= I2 + 2H2O |
| C.磨口玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH- = Na2SiO3↓+H2O |
| D.NaHCO3溶液和少量Ba(OH)2溶液混合:HCO3- + OH-+ Ba2+ = H2O + BaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述正确的是
| A.加入铝粉能产生H2的溶液中可能大量共存的离子组:NH4+、Fe2+、SO42-、NO3- |
| B.常温下由水电离出的H+与OH-的浓度积为10-20mol2·L-2的溶液中可能大量共存的离子组:Na+、S2-、Cl-、CO32- |
| C.向FeI2溶液中通入过量Cl2的离子方程式:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| D.向Ca(ClO)2溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O=2HClO+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子方程式的书写正确的是
A.硫氢化钠溶液中滴人硫酸铜溶液: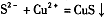 |
B.次氯酸钠溶液中加入双氧水有氧气产生: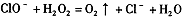 |
C.二氧化硫通入氯化铁溶液: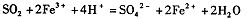 |
D.从酸化的海带灰浸出液中提取碘: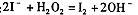 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子方程式正确的是
| A.用稀氢氧化钠溶液吸收二氧化氮:2OH-+2NO2 = NO+2NO↑+H2O |
B.NH4HCO3溶液与足量KOH浓溶液共热:NH+OH-  NH3↑+H2O NH3↑+H2O |
| C.铁溶于足量的稀硝酸,溶液变黄:3Fe+8H++2NO= 3Fe2++2NO↑+4H2O |
| D.NaHSO4溶液与NaOH溶液混合:OH-+H+= H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com