
| A. | 3-甲基-2-戊烯 | B. | 3-甲基-2-丁烯 | C. | 2,2-二甲基丙烷 | D. | 3-甲基-1-丁炔 |
分析 判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
(1)烷烃命名原则:
①长--选最长碳链为主链;
②多--遇等长碳链时,支链最多为主链;
③近--离支链最近一端编号;
④小--支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近--离支链最近一端编号”的原则;
⑤简--两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面.
(2)有机物的名称书写要规范;
(3)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小.
解答 解:A、3-甲基-2-戊烯,主碳链有五个碳原子,离双键近的一端编号,符合命名原则,故A正确;
B、3-甲基-2-丁烯不符合离支链最近一端编号,正确的命名:2-甲基-2-丁烯,故B错误;
C、2,2-二甲基丙烷符合命名原则,故C正确;
D、3-甲基-1-丁炔,主碳链上四个碳原子,离碳碳三键的一端编号,名称符合命名原则,故D正确;
故选B.
点评 本题考查了有机物的系统命名方法,依据名称写出结构简式,用正确的命名方法命名对比分析,题目较简单.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:解答题
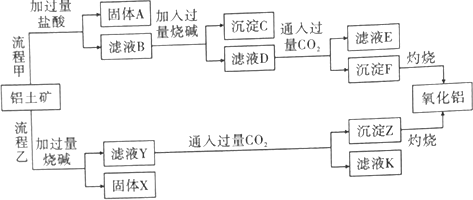
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向100mL0.1mol•L-1的Na2CO3溶液中滴加含0.01molCH3COOH的醋酸溶液CO32-+CH3COOH═HCO3-+CH3COO- | |
| B. | 4mol•L-1的NaAlO2溶液和7mol•L-1的盐酸等体积均匀混合4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ | |
| C. | 等物质的量的FeBr2与Cl2反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 将少量SO2通入NaClO溶液中:SO2+ClO-+H2O═SO42-+Cl-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8g甲烷中含C-H键的数目为4NA | |
| B. | 25℃时,1L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 1 mol冰醋酸和1mol乙醇经催化加热反应生成H2O的分子数为NA | |
| D. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
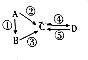
| 物质 | A | B | C | D |
| 元素种类 | 1 | 2 | 3 | 3 |
 ,物质C的化学式是HClO,写出反应A→D的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
,物质C的化学式是HClO,写出反应A→D的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com