
 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.| 较大量存在的含金属元素的离子 | 检验方法 |
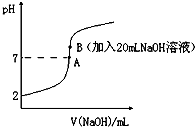
分析 由图象可知,pH变化缓慢的主要原因应为:生成Mg(OH)2沉淀,消耗OH-;生成Al(OH)3沉淀消耗OH-; Al(OH)3沉淀溶解,消耗OH-三种可能,至于哪一阶段为那种可能,应与 Al(OH)3、Mg(OH)2二者的溶解度有关.
解答 解:(1)精确控制加入NaOH溶液的体积,应用精确度0.01ml的滴定管,又NaOH呈碱性,故选用碱式滴定管,故答案为:碱式滴定管;
(2)由图象可知,PH变化缓慢的主要原因应为:生成Mg(OH)2沉淀,消耗OH-;生成Al(OH)3沉淀消耗OH-; Al(OH)3沉淀溶解,消耗OH-三种可能,第一阶段(a点前)应该是生成沉淀消耗了滴下去的氢氧化钠,故现象为:生成白色沉淀并逐渐增多,
故答案为:生成白色沉淀并逐渐增多;
(3)根据分析可知,PH变化缓慢的主要原因应为:生成Mg(OH)2沉淀,消耗OH-;生成Al(OH)3沉淀消耗OH-; Al(OH)3沉淀溶解,消耗OH-三种可能,若推测1符合实际情况,b、c之间生成Mg(OH)2沉淀,消耗OH-,则a点之前应该是产生氢氧化铝的反应,所以反应的离子方程式为Al3++3OH-═Al(OH)3↓,据此说明在碱性溶液中铝离子比镁离子更易沉淀,所以Al(OH)3比Mg(OH)2更难溶于水,
故答案:生成Al(OH)3沉淀消耗OH-;Al(OH)3沉淀溶解,消耗OH-;Al3++3OH-═Al(OH)3↓;Al(OH)3比Mg(OH)2更难溶于水;
(4)根据以上分析得出,e点前的反应为Al(OH)3+OH-═Al(OH)4-,所以e点后溶液中较大量存在的含金属元素的离子为钠离子和Al(OH)4-离子,
故答案为:
| 较大量存在的含金属元素的离子 | 检验方法 |
| Na+ | 用洁净的铂丝蘸取少量待测液在酒精灯火焰上灼烧,若火焰呈黄色,表明存在Na+ |
| [Al(OH)4]- | 取少量待测液于试管中,滴加盐酸,产生白色沉淀,盐酸过量时,沉淀又溶解 |
点评 本题考查了学生根据图象分析反应过程的能力,解题关键还在于熟悉有关镁铝的性质,题目难度中等,侧重于考查学生的分析能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF═H++F-.25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示.
氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF═H++F-.25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HN3水溶液中微粒浓度大小顺序为:c(H+)>c( N3-)>c(HN3)>c(OH-) | |
| B. | NaN3水溶液中离子浓度大小顺序为:c(Na+)>c( N3-)>c(OH-)>c(H+) | |
| C. | HN3与NH3作用生成的叠氮酸铵是强电解质 | |
| D. | N3-与CO2互为等电子体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是放热反应都是自发的,由于吸热反应都是非自发的 | |
| B. | 自发反应一定是熵增大,非自发反应一定是熵减少或不变 | |
| C. | 电解池的反应属于自发过程 | |
| D. | 自发反应在恰当条件下才能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难溶于水 | B. | 易挥发,有毒性 | ||
| C. | 苯分子中含有碳碳双键 | D. | 属于烃类化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com