
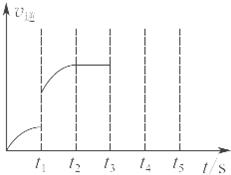
 ij�¶�ʱ�������Ϊ5L���ܱ������м���2mol Fe��s����1mol H2O��g����t1��ʱ��H2�����ʵ���Ϊ0.20mol������t2��ʱǡ�ôﵽƽ�⣬��ʱH2�����ʵ���Ϊ0.35mol��
ij�¶�ʱ�������Ϊ5L���ܱ������м���2mol Fe��s����1mol H2O��g����t1��ʱ��H2�����ʵ���Ϊ0.20mol������t2��ʱǡ�ôﵽƽ�⣬��ʱH2�����ʵ���Ϊ0.35mol��| 0.03 |
| t2-t1 |
| 0.03 |
| t2-t1 |
| ||
| ||
| t2-t1 |
| 0.03 |
| t2-t1 |
| 0.03 |
| t2-t1 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
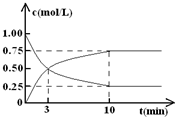 ��ν��ʹ�����CO2�ĺ�������Ч�ؿ�������̼��Դ���о��Ե���Ϊ���ȣ�
��ν��ʹ�����CO2�ĺ�������Ч�ؿ�������̼��Դ���о��Ե���Ϊ���ȣ�| ���� |
| �¶�/k CO2ת����/% n��H2��/n��CO2�� |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ij�¶��£������Ϊ2L���ܱ������У�����1mol A��a mol B���壬�������·�Ӧ��A��g��+B��g��?2C��g����5min��Ӧ�ﵽƽ��ʱn��A��Ϊ0.4mol���ڷ�Ӧ��������ϵ���¶ȳ������ߣ�ʵ���û��������C�ĺ������¶ȵĹ�ϵ������ͼ��ʾ������������ȷ���ǣ�������
ij�¶��£������Ϊ2L���ܱ������У�����1mol A��a mol B���壬�������·�Ӧ��A��g��+B��g��?2C��g����5min��Ӧ�ﵽƽ��ʱn��A��Ϊ0.4mol���ڷ�Ӧ��������ϵ���¶ȳ������ߣ�ʵ���û��������C�ĺ������¶ȵĹ�ϵ������ͼ��ʾ������������ȷ���ǣ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ʡ������ѧ2011��2012ѧ��߶���ѧ�����п��Ի�ѧ����(�˽̰�) ���ͣ�013
|
ij�¶��£������Ϊ5 L���ܱ������У�����1 mol��A���壬�������¿��淴Ӧ��2A(g)
| |
| [����] | |
A�� |
0��2 minʱ����B���ʵ�ƽ����Ӧ����Ϊ0.03 mol/(L��min) |
B�� |
�÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ����CΪ���������� |
C�� |
�ﵽƽ������¶Ⱥ�����������䣬�ٳ���1 mol��A��ƽ��������Ӧ�����ƶ� |
D�� |
���¶Ⱥ�����������䣬��ʼʱ����B��C��0.5 mol����ﵽƽ��ʱ��n(A)С��0.4 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
![]() B��g��+C��g������H=a kJ/mol��a��0��
B��g��+C��g������H=a kJ/mol��a��0��
2 min��Ӧ��ƽ�⣬AΪ0.4 mol�����������в���ȷ����
A.B���ʵķ�Ӧ����Ϊ0.03 mol/��L��min��
B.��ַ�Ӧ��Ӧ���յ�����Ϊa kJ
C.��ƽ������¶Ⱥ�����������䣬�ٳ���1 molA��ƽ��������Ӧ�����ƶ�
D.���¶Ⱥ�����������䣬��ʼʱ����B��C��0.5 mol�����ƽ��ʱ��A�����ʵ�����Ϊ0.4 mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com