
在标准状况下,烧瓶内充入HCl气体,将此烧瓶倒扣在盛水的水槽内,当液面上升到烧瓶容积的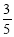 时,此时烧瓶内溶液的物质的量浓度为( 不考虑溶质的扩散 ) ( )
时,此时烧瓶内溶液的物质的量浓度为( 不考虑溶质的扩散 ) ( )
A .0?74 mol / L B .0?045 mol / L C. 0?037 mol / L D. 0?025 mol / L
科目:高中化学 来源:2015-2016学年福建省宁德市高一上学期期中测试化学试卷(解析版) 题型:选择题
设NA代表阿伏加德罗常数的数值,下列说法中正确的是
A.常温常压下,32g氧气所含的原子数为NA
B.标准状况下,22.4L 水的分子数为NA
C.0℃,101KPa下,44.8L氮气所含有的分子数为2NA
D.常温常压下,1mol二氧化碳气体含有的原子数为2NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江台州中学高二上第三次统练化学试卷(解析版) 题型:简答题
氨气是重要化工产品之一。传统的工业合成氨技术的反应原理是:
N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一固定容积的密闭容器中反应,反应过程中各种物质的量变化如图所示,回答下列问题:
2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一固定容积的密闭容器中反应,反应过程中各种物质的量变化如图所示,回答下列问题:
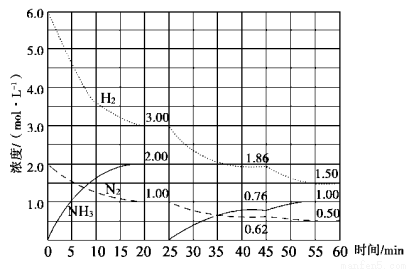
(1)计算反应在第一次平衡时的平衡常数K= 。(保留二位小数)
(2)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 。
(3)45 min时刻改变的条件是 。
(4)产物NH3在5~10 min、25~30min和45~50 min时平均反应速率从大到小的排列次序为 (平均反应速率分别以v1、v2、v3表示)。
(5)随着条件的改变,达到三次平衡时H2的转化率也发生[了变化,如分别以α1、α2、α3表示,其中最小的是 。
(6)请在图中用实线表示25~45、45~60min 两阶段化学平衡常数K的变化图像。

查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南衡阳第八中学高一上六科联赛化学卷(解析版) 题型:选择题
下列各组在溶液中进行的两个反应,可用同一离子方程式表示的是
A.CaCO3和HCl ;Na2CO3和HCl B.BaCl2 和H2SO4 ;Ba(OH)2和H2SO4
C.HCl 和Na2CO3 ;HCl和NaHCO3 D.KOH 和H2SO4;Ba(OH)2和HNO3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德市高二12月月考化学卷(解析版) 题型:选择题
下列物质中属于高分子化合物的是()
①油脂、②蔗糖、③羊毛、④葡萄糖、⑤纤维素、⑥谷氨酸、⑦胃蛋白酶
A.①⑤⑦ B.②④⑥ C.③⑤⑦ D. ④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江齐齐哈尔实验中学高二上期中化学卷(解析版) 题型:实验题
维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6(相对分子质量为176),人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸。维生素C易被空气中的氧气氧化。在新鲜的水果、蔬菜、乳制品中都富含维生素C,如新鲜橙汁中维生素C的含量在500 mg·L-1左右。校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量。下面是测定实验分析报告,请填写有关空白。
(1)测定目的:测定××牌软包装橙汁维生素C含量。
(2)测定原理:C6H8O6+I2  C6H6O6+2H++2I-。
C6H6O6+2H++2I-。
(3)实验用品及试剂:
①仪器和用品(自选,略)。
②试剂:指示剂 (填名称)、浓度为7.50×10-3mol·L-1标准碘溶液、蒸馏水等。
(4)实验过程:
①洗涤仪器:检查滴定管是否漏液,润洗后装好标准碘溶液待用。
②打开橙汁包装,目测:颜色——橙黄色,澄清度——好。用 (填仪器名称)向锥形瓶中移入25.00 mL待测橙汁,滴入2滴指示剂。
③用左手控制滴定管的 (填部位的名称),右手摇动锥形瓶,眼睛注视 直到滴定终点。滴定至终点的现象是 。
(5)数据记录与处理。滴定中消耗标准碘溶液的体积见下表,请计算此橙汁中维生素C的含量是② mg·L-1。
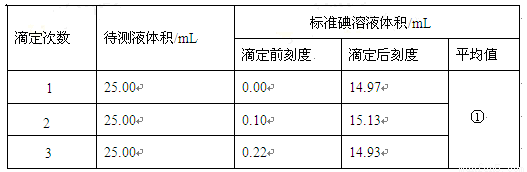
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三化学一诊模拟理综化学试卷(解析版) 题型:实验题
某课外活动小组设计了以下实验方案验证Ag与浓HNO3反应的过程中可能产生NO。其实验流程图如下:

(1)测定硝酸物质的量:反应结束后,从下图B装置中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L -1 的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如右上图所示。在B容器中生成硝酸的物质的量为__________,则Ag与浓硝酸反应过程中生成的NO2的物质的量为____________。
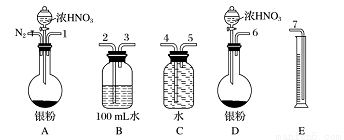
(2)测定NO的体积:①从上图所示的装置中,你认为应选用________装置进行Ag与浓硝酸反应实验,选用的理由是______________________。
②选用上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是_____(填各导管口编号)。
③在读取量筒内液体体积之前,应进行的操作________________________________。
(3)气体成分分析:若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中______________ (填“有”或“没有”)NO产生,作此判断的依据是_______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上期中考试化学试卷(解析版) 题型:选择题
对于0.1mol•L-1 Na2SO3溶液,正确的是( )
A.升高温度,溶液的pH降低
B. c(Na+)=2 c(SO32―)+ c(HSO3―)+ c(H2SO3)
C.加入少量NaOH固体,c(SO32―)与c(Na+)均增大
D.c(Na+)+c(H+)=2 c(SO32―)+ 2c(HSO3―)+ c(OH―)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南国兴中学高二上第三次月考化学试卷(解析版) 题型:选择题
两种气态烃以任意比例混合,在105 ℃时,2L该混合烃与8L氧气混合,充分燃烧后恢复原状态,所得气体体积仍为10L。下列各组混合烃中不符合此条件的是
A.CH4 C2H4 B.CH4 C2H6 C.C2H4 C3H4 D.C2H2 C3H6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com