
已知反应A(g)+3B(g) 2C(g)+D(s),1molA和3molB在2L密闭容器中进行上述反应,若2min后,测得C的浓度为0.2mol/L,则下列说法正确的是( )
2C(g)+D(s),1molA和3molB在2L密闭容器中进行上述反应,若2min后,测得C的浓度为0.2mol/L,则下列说法正确的是( )
A.v(D)=0.05mol/(L•min) B.v(B)=0.15mol/(L•min)
C. 3v(B)=2v(C) D.A的转化率为40%
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
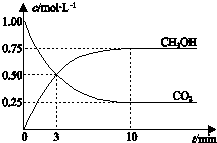
| A. | 升高温度能使$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$ 增大 | |
| B. | 反应达到平衡状态时,CO2的平衡转化率为75% | |
| C. | 3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 | |
| D. | 从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
已知下列两个气态物质之间的反应:
C2H2(g)+H2(g)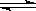 C2H4(g)①
C2H4(g)①
2CH4(g)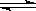 C2H4(g)+2H2(g)②
C2H4(g)+2H2(g)②
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:
(Q1、Q2、Q3均为正值)
C(s)+2H2(g)=CH4(g)ΔH=-Q1
2C(s)+H2(g)=C2H2(g)ΔH=-Q2
2C(s)+2H2(g)=C2H4(g)ΔH=-Q3Q值大小比较正确的是( )
A. Q1>Q3>Q2 B. Q1>Q2>Q3 C. Q2>Q1>Q3 D. Q3>Q1>Q2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
已知某可逆反应m A(g)+n B(g)  p C(g) △H,在密闭容器中进行,如图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线.由曲线分析,下列判断正确的是( )
p C(g) △H,在密闭容器中进行,如图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线.由曲线分析,下列判断正确的是( )
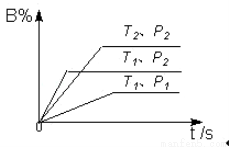
A.T 1<T2,P1>P2,m+n>p,△H<0
1<T2,P1>P2,m+n>p,△H<0
B.T1>T2,P1<P2,m+n>p,△H>0
C.T1<T2,P1>P2,m+n<p,△H<0
D.T1>T2,P1<P2,m+n<p,△H>0
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考一化学试卷(解析版) 题型:填空题
在一定温度下,向一个容积不变的容器中,通入2mol SO2和2mol O2及固体催化剂,使之反应。2SO2(g)+O2(g) 2SO3(g);ΔH=-196 KJ/mol。平衡时容器内气体压强为起始时的90%。此时
2SO3(g);ΔH=-196 KJ/mol。平衡时容器内气体压强为起始时的90%。此时
(1)加入2mol SO2和2mol O2发生反应,达到平衡时,放出的热量为 ;
(2)保持同一反应温度,在相同的容器中,将起始物质的量改为amol  SO2、bmol O2、cmol SO3(g),欲使平衡时SO3的体积分数为2/9,
SO2、bmol O2、cmol SO3(g),欲使平衡时SO3的体积分数为2/9,
①达到平衡时,⑴与⑵放出的热量 (填序号)。
A.一定相等 B.前者一定小 C.前者大于或等于后者
②a、b、c必须满足的关系是 、 (一个用a、c表示,另一个用 b、c表示),
b、c表示),
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考一化学试卷(解析版) 题型:选择题
已知某化学反应的平衡常数表达式为K=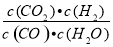 ,在不同的温度下该反应的平衡常数如表所示:
,在不同的温度下该反应的平衡常数如表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是( )
A.该反应的化学方程式是CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.若在1L的密闭容器中通入CO2和H2各1mol,5min后温度升高到830℃,此时测得CO2为0.4mol时,该反应达到平衡状态
D.若平衡浓度符合下列关系式: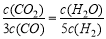 ,则此时的温度为1000℃
,则此时的温度为1000℃
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:实验题
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
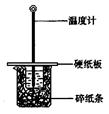
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 (填“偏大”、“偏小”、“无影响”,下同) 若用KOH代替NaOH,测定结果会 __ __
(5)他们记录的实验数据如下:
实 验 用 品 | 溶 液 温 度 | 中和热△H | |||
t1 | t2 | ||||
① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.3℃ | |
② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | |
已知反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
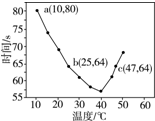
| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 图中b、c两点对应的NaHSO3的反应速率相等 | |
| C. | 图中a点对应的NaHSO3的反应速率为5.0×10-5 mol•(L•s)-1 | |
| D. | 温度高于40℃时,淀粉不宜用作该实验的指示剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com