
【题目】D、E为中学化学常见的金属单质且D常呈红色,F是一种黑色晶体。E与C的浓溶液在常温作用呈钝化现象,加热时则有大量无色气体产生,同时生成H。在一定条件下C、D间能发生反应。各物质转化关系如下图:

(1)已知1g E在B中燃烧放出的热量为Q kJ,试写出表示E燃烧的热化学方程式____;
(2)用惰性电极电解一定浓度的A的水溶液,阳极反应式为_____________________,通电一段时间后,向所得溶液中加入8.0g D的氧化物后恰好恢复到电解前的浓度,则电解过程中收集到标准状况下的气体体积为_____________升。
【答案】 Fe(s)+2/3 O2(g)=1/3Fe3O4(s) △H=-56Q kJ/mol 4OH--4e-=2H2O+O2↑ 1.12
【解析】电解A溶液生成三种物质,D为金属且常呈红色,则D为Cu,A为含氧酸的铜盐,在阴极生成金属,则阳极应生成O2,其中E可在B中燃烧说明B为O2,C为含氧酸,B与金属E反应得到F是一种黑色晶体,F为氧化物,F与酸反应后生成两种盐,说明金属为变价金属,则E应为Fe,则C为H2SO4,不可能为硝酸,否则四氧化三铁与硝酸反应只生成一种物质,故F为Fe3O4,G为FeSO4,H为Fe2(SO4)3,A应为CuSO4.。
(1)已知1g Fe在氧气中燃烧放出的热量为Q kJ,表示Fe燃烧热的热化学方程式为:
Fe(g) + 2/3 O2(g)== 1/3 Fe3O4(s) △H=-56Q kJ/mol;
(2)用惰性电极电解一定浓度的CuSO4的水溶液,电解时,在阴极生成金属,则阳极应生成O2,阳极反应式为:4OH--4e-=2H2O+O2↑,通电一段时间后,向所得溶液中加入8.0g CuO后恰好恢复到电解前的浓度和pH,而电解过程相当于析出CuO,故生成氧气为(8g/80g/mol)/2=0.05mol,则电解过程中收集到标准状况下的气体体积为0.05mol×22.4L/mol=1.12L;


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示. 已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差l.下列说法正确的是( ) 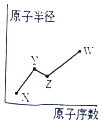
A.Y、Z、W处于同一周期
B.X、Y、Z、W的原子序数递增
C.X、W可形成化学式为XW的离子化合物
D.简单离子半径是Z大于W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期三种元素X、Y、Z,原子序数依次递增,它们的最高价氧化物的水化物皆为强酸,下列说法不正确的是( )
A. Y 在自然界中存在游离态 B. 最高正价:X > Y > Z
C. Y 气态氢化物溶于水呈酸性 D. 非金属性:Y < Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用萃取法从碘水中分离碘,所用萃取剂应具有的性质是( ) ①不和碘或水起化学反应 ②能溶于水 ③不溶于水 ④应是极性溶剂 ⑤应是非极性溶剂.
A.①②⑤
B.②③④
C.①③⑤
D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝锂合金、碳纤维陶瓷复合材料广泛应用于我国自主研发的C919 大型民用客机。下列有关说法中正确的是( )
A. 合金中不可能含有非金属元素
B. 碳纤维陶瓷复合材料中碳纤维是基体
C. 碳纤维陶瓷复合材料属于高分子有机合成材料
D. 铝锂合金具有质量轻、强度高等优异性能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.所有的电子在同一区域里运动
B.能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动
C.处于最低能量的原子叫基态原子
D.同一原子中,1s、2s、3s所能容纳的电子数越来越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用碱式碳酸铜[CuCO3·Cu(OH)2]制取铜粉并测定铜粉纯度的实验如下:
步骤1:将一定量的碱式碳酸铜置于烧杯中,向烧杯中加入N2H4的水溶液,边搅拌边加热,有大量的气体生成和红色铜析出,将沉淀过滤、低温干燥得红色粉末。
步骤2:称取1.9600 g红色粉末于烧杯中,缓慢加入足量稀硫酸,边加热边通入氧气使粉末完全溶解。冷却,将溶液移入100 mL 容量瓶中,用水稀释至刻度。
书骤3:准确量取20.00mL的溶液,调节溶液呈弱酸性,向其中加入过量的KI.,充分反应后,以淀粉溶液作指示剂,用0.2000mol/LNa2S2O3标准溶液滴定,滴定终点时共消耗Na2S2O3标准溶液30.00 mL.过程中所发生的反应如下:Cu2++I-![]() CuI↓+I3-(未配平),I3-+S2O32-=S4O62-+I-(未配平)。
CuI↓+I3-(未配平),I3-+S2O32-=S4O62-+I-(未配平)。
(1)步骤1中所发生反应的化学方程式为_________________。
(2)步骤2 中所发生反应的离子方程式为_________________。
(3)步骤3 中加入过量KI的作用是_________________。
(4)若铜粉中杂质不参与步骤3 的反应,通过计算确定红色粉末中含铜质量分数(写出计算过程)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空:
(1)反应3A(g)+B(g)═2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1 mol/(Lmin)、②vC=0.5mol/(Lmin)、③vB=0.5mol/(Lmin),三种情况下该反应速率由大到小的关系是 . (用序号表示)
(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空: 
①该反应的化学方程式为 .
②反应开始至2min,以气体Z表示的平均反应速率为 .
③2min反应达平衡容器内混合气体的平均相对分子质量比起始时(填“大”,“小”或“相等”下同),混合气体密度比起始时 .
④上述反应,在第2min时,X的转化率为 .
⑤将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n (X)=n (Y)=n (Z),则原混合气体中a:b= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纳米级微粒物质溶解于液体溶剂中形成一种分散系,对该分散系及分散质颗粒的叙述中不正确的是( )
A. 该分散系能发生丁达尔现象 B. 该分散质颗粒能透过滤纸
C. 该分散质颗粒能透过半透膜 D. 该分散质颗粒能发生布朗运动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com