
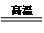 H2+CO,CH4+H2O
H2+CO,CH4+H2O 3H2+CO;
3H2+CO; ;
;分析 Ⅰ各项所加试剂均应过量才符合题目要求,A项溶液形成络离子,B项生成硫化铜、硫化汞、硫化铅等沉淀,C项硫酸铜不是沉淀,D项均能通过双水解调节pH转化为沉淀;
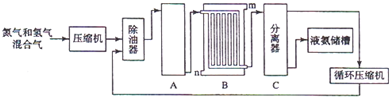
Ⅱ(1)分离空气提取氮气的方法有两种,以上液化、分馏空气,另一种为空气与碳反应生成二氧化碳,反应后除去二氧化碳气体;制取氢气可用碳和水反应或甲烷与水反应;
(2)合成氨的设备为合成塔,发生N2(g)+3H2(g)$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3(g);
(3)冷凝分离设备为冷凝塔或冷凝器;水流和气流方向应逆向;
(4)分离器用来分离液氨和原料气;
(5)根据平衡常数用三段式法计算.
解答 解:ⅠA.加入氨水,易形成络离子,不能生成沉淀,故A错误;
B.加入硫化氢气体,生成硫化铜、硫化汞、硫化铅等沉淀,故B正确;
C.不能使Cu2+生成沉淀,故C错误;
D.均能通过双水解调节pH转化为沉淀,故D正确.
故答案为:AC;
Ⅱ(1)分离空气提取氮气的方法有两种,以上液化、分馏空气,另一种为空气与碳反应生成二氧化碳,反应后除去二氧化碳气体;C和水反应的方程式为C+H2$\frac{\underline{\;高温\;}}{\;}$CO+H2,甲烷与水反应的方程式为CH4+H2O$\frac{\underline{催化剂}}{△}$CO+3H2,
故答案为:液化、分馏;与碳反应后除去CO2;C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2;CH4+H2O$\frac{\underline{催化剂}}{△}$CO+3H2;
(2)合成氨的设备为合成塔,发生N2(g)+3H2(g)$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3(g),
故答案为:合成(氨)塔;N2(g)+3H2(g)$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$ 2NH3(g);
(3)冷凝分离设备为冷凝塔或冷凝器,水流和气流方向应逆向,则入水口是n,高温气体由冷凝塔上端进入,冷凝水从下端进入,可使冷水充满冷凝器,逆向冷凝效果好,
故答案为:冷凝塔或冷凝器;n;高温气体由冷凝塔上端进入,冷凝水从下端进入,逆向冷凝效果好;
(4)分离器用来分离液氨和原料气,故答案为:将液氨与未反应的原料气分离;
(5)设CO的起始浓度为xmol,H2O的起始浓度为ymol,则转化的CO的最小值为0.9x,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始 x y 0 0
变化 0.9x 0.9x 0.9x 0.9x
平衡 0.1x y-0.9x 0.9x 0.9x,
根据平衡常数列式:$\frac{(0.9x)^{2}}{0.1x×(y-0.9x)}$=0.627,
解得:$\frac{y}{x}$=13.8,故此只要此值大于13.8,转化率就会超过90%.
故答案为:13.8.
点评 本题综合考查工业合成氨知识,涉及物质的分离、化学平衡的等问题,题目难度中等,注意把握物质的性质,根据性质选择分离方法,易错点为(5),注意利用三段式法计算较为直观.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | HClO2 | HF | HCN | H2S |
| Ka | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10-8K2=1.1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| (1)实验步骤 | 有关问题 |
| ①计算所需Na2SO4的质量 | 需要称量Na2SO4的质量为2.8g |
| ②称量Na2SO4固体 | 称量需要用到的主要仪器是:托盘天平 |
| ③将Na2SO4加入100mL烧杯中,并加入适量水 | 用玻璃棒搅拌至完全溶解,冷却至室温 |
| ④将烧杯中溶液转移至仪器A中(已检查不漏水) | 仪器A是100mL容量瓶; |
| ⑤洗涤烧杯,转移,定容 | |
| ⑥摇匀、装瓶、贴上标签 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②③④ | C. | ②④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | R的气态氢化物的水溶液显酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com