
 (1)Q单质的电子式为_______。
(1)Q单质的电子式为_______。 W、X、Y的离子半径由大到小的顺序为____(用离子符号回答)。
W、X、Y的离子半径由大到小的顺序为____(用离子符号回答)。 (2)X和Y组成的化合物放入水中反应的化学方程式是______________________________。
(2)X和Y组成的化合物放入水中反应的化学方程式是______________________________。 (4)ZO在高温下被Q的简单气态氢化物还原为Z单质,写出反应的化学方程式____________。
(4)ZO在高温下被Q的简单气态氢化物还原为Z单质,写出反应的化学方程式____________。 (1)
(1)
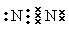 (1分) S2->O2->Al3+(2分)
(1分) S2->O2->Al3+(2分) (2)Al2S3 + 6H2O=2Al(OH)3↓+ 3H2S↑(2分)
(2)Al2S3 + 6H2O=2Al(OH)3↓+ 3H2S↑(2分) (4)3CuO + 2NH3
(4)3CuO + 2NH3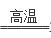 3Cu + N2 + 3H2O (2分)
3Cu + N2 + 3H2O (2分) (1)氮气分子中含有氮氮三键,单质的电子式为
(1)氮气分子中含有氮氮三键,单质的电子式为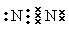 。
。 离子核外电子层数越多,离子半径越大。在核外电子排布相同的条件下原子序数越小离子半径越大,则W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+。
离子核外电子层数越多,离子半径越大。在核外电子排布相同的条件下原子序数越小离子半径越大,则W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+。 (2)X和Y组成的化合物是硫化铝,溶于水与水反应生成氢氧化铝和硫化氢,则放入水中反应的化学方程式是Al2S3 + 6H2O=2Al(OH)3↓+ 3H2S↑。
(2)X和Y组成的化合物是硫化铝,溶于水与水反应生成氢氧化铝和硫化氢,则放入水中反应的化学方程式是Al2S3 + 6H2O=2Al(OH)3↓+ 3H2S↑。 (4)CuO在高温下被氨气还原为铜单质,而氨气的还原产物是氮气,根据原子守恒还有水生成,则反应的化学方程式为3CuO + 2NH3
(4)CuO在高温下被氨气还原为铜单质,而氨气的还原产物是氮气,根据原子守恒还有水生成,则反应的化学方程式为3CuO + 2NH3 3Cu + N2 + 3H2O。
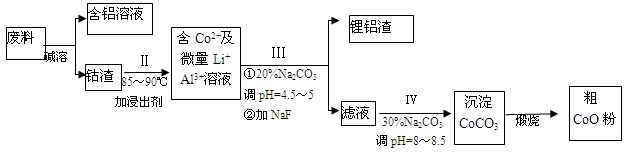
3Cu + N2 + 3H2O。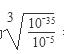 =10-10mol/L,则溶液pH对于4,因此最终调解pH=4,再过滤。
=10-10mol/L,则溶液pH对于4,因此最终调解pH=4,再过滤。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.Cl2既是氧化剂又是还原剂 |
| B.每有1molCl2参加反应,就有2mol电子转移 |
| C.该反应可用于实验室制Cl2时尾气的吸收 |
| D.该反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子半径:Na+>N3->H+ |
| B.反应①和②都是氧化还原反应 |
| C.反应②每生成1molH2,转移的电子数为NA |
| D.Na3N和NaH与盐酸反应都只生成一种盐 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2O2既是氧化剂又是还原剂 |
| B.Fe2O3在反应中得到电子 |
| C.3 mol Na2O2发生反应,有12 mol e-发生转移 |
| D.Na2FeO4能消毒杀菌是因其具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.60 ml | B.45 ml. | C.30 mL | D.15mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题



查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
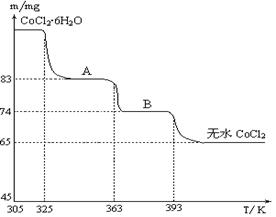
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②④⑤ | B.①③⑤ |
| C.①②③④ | D.只有①③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (NxOy)+ H2O(配平时x、y用具体数值表示,物质填在
(NxOy)+ H2O(配平时x、y用具体数值表示,物质填在 中)。
中)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com