
已知汽车尾气无害化处理反应为:2NO(g)+2CO(g) N2(g)+2CO2(g)。下列说法不正确的是( )
N2(g)+2CO2(g)。下列说法不正确的是( )
A.升高温度可使该反应的逆反应速率降低
B.使用高效催化剂可有效提高该反应的速率
C.反应达到平衡后,NO的反应速率保持恒定
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
科目:高中化学 来源: 题型:
某酸式盐NaHY的水溶液中有[OH-]>[H+],下列叙述正确的是( )
A.H2Y的电离方程式:H2Y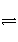
 2H++Y2-
2H++Y2-
B.HY-的水解方程式:HY-+H2O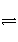
 H3O++Y2-
H3O++Y2-
C.该酸式盐溶液中离子浓度关系:[Na+]>[HY-]>[OH-]>[H+]
D.该酸式盐溶液中离子浓度关系:[Na+]>[Y2-]>[HY-]>[OH-]>[H+]
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)H2(g)+I2(g)。若c(HI)由1.0 mol·L-1降低到0.7 mol·L-1时,需要15 s,那么c(HI)由0.7 mol·L-1降到0.5 mol·L-1时,所需反应的时间为( )
A.等于5 s B.等于10 s
C.大于10 s D.小于10 s
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 | K a=1.75×10-5 | K a=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
A.25℃,等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3
B.将0.1 mol·L-1的醋酸加水不断稀释,所有离子浓度均减小
C.少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:
SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
D.少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
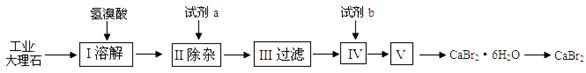
完成下列填空:
(1)上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸的HBr
500ml,所需的玻璃仪器有玻璃棒、烧杯、量筒、 ▲ 、 ▲ 。
(2)已知步骤Ⅲ的滤液中不含NH4+。步骤Ⅱ加入的试剂a是 ▲ ,控制溶液的pH
约为8.0的目的是 ▲ 。步骤Ⅳ的目的是 ▲ 。
(3)制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤、洗涤、
干燥、称量。若得到1.88g碳酸钙,则溴化钙的质量分数为 ▲ (保留两位小数)。
②若实验操作规范而测定结果偏低,其原因是 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实均能说明醋酸是弱电解质的是( )
①醋酸与水能以任意比互溶 ②醋酸溶液能导电 ③醋酸溶液中存在醋酸分子 ④0.1 mol/L醋酸溶液的pH比0.1 mol/L盐酸的pH大 ⑤醋酸能和碳酸钙反应放出CO2 ⑥大小相同的锌粒与相同物质的量浓度的盐酸和醋酸溶液反应,开始醋酸产生H2速率慢
A.②③⑥ B.④⑤⑥ C.③④⑥ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则同温同体积同浓度的HCN和HC1O说法正确的是( )
A.电离程度:HCN>HClO
B.pH:HClO>HCN
C.NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN
D.酸根离子浓度:c(ClO--)>c(CN--)
查看答案和解析>>
科目:高中化学 来源: 题型:
按下述实验方法制备气体,合理又实用的是( )
A.锌粒与稀HNO3反应制备H2
B.加热分解NH4Cl固体制NH3
C.亚硫酸钠与浓H2SO4反应制备SO2
D.大理石与稀H2SO4反应制备CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
含H-的化合物跟氨反应:H-+NH3===NH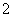 +H2。根据该反应事实,可以得出的正确结论是
+H2。根据该反应事实,可以得出的正确结论是
)
A.NH3具有还原性
B.含H-的化合物是强氧化剂
C.H2既是氧化产物又是还原产物
D.该反应属于置换反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com