
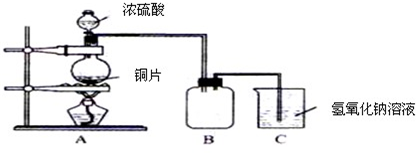
①溶液2加水稀释,可使TiO2+水解生成白色沉淀TiO(OH)2,原因是_______________。
②工业上在800℃~1 000℃下,电解TiO2可制得海绵钛,其装置示意图如上图3。写出其阴极的电极反应式:_____________________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
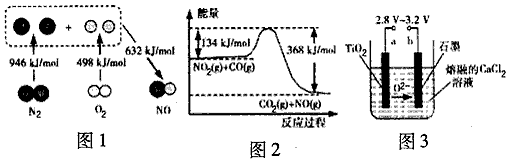
 N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.| 时间/h | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.5×10-4 | 2.5×10-4 | 1.5×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.6×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 催化剂 |
| ||
| 催化剂 |



查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2013届广东省佛山一中高三第二次段考化学试卷(带解析) 题型:填空题
(13分)碳及其化合物有广泛的用途。
(1)写出用碳棒作电极电解饱和食盐水的离子方程式: 。 (2)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g)
(2)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g)
ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是 。
| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO |
 (3)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
(3)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
 2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com