
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)烧杯间填满碎泡沫塑料的作用是_________________________。
(3)理论上稀的强酸溶液与强碱溶液反应生成1 mol水时放出57.3 kJ的热量,写出表示稀盐酸和稀氢氧化钠溶液反应的中和热的热化学方程式:_______________。
(4)大烧杯上如不盖硬纸板,求得的中和热数值______(填“偏大”、“偏小”或“无影响”)。
(5)实验中改用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等”或“不相等”),所求中和热__________(填“相等”或“不相等”),简述理由:________________________________________________。
(6)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会____________(填“偏大”“偏小”或“无影响”)。
【答案】(1)环形玻璃搅拌棒
(2)保温隔热,减少热量损失
(3)HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-57.3kJ/mol或H+(aq)+OH—(aq)=H2O(l) ΔH=-57.3kJ/mol
(4)偏小
(5)不相等;相等;中和热是酸碱中和生成1molH2O时放出的热量,与反应物实际用量无关
(6)偏小
【解析】
试题分析:(1)根据装置图可知还缺少环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是:减少实验过程中的热量损失;
(3)在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,满足此反应的热化学方程式为HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-57.3kJ/mol。
(4)大烧杯上如不盖硬纸板,则热量损失,求得的中和热数值偏小;
(5)若用60mL 0.50mol/L的盐酸与50mL 0.55mol/L的氢氧化钠溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关;
(6)氨水是弱碱,存在电离平衡,电离吸热,则用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值偏小。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】“关爱生命,注意安全”。惨痛的天津爆炸触目惊心,火灾之后依然火势绵延不绝的原因之一是易燃物中含有电石。工业上常用电石(主要成分为CaC2,杂质为CaS等)与水反应生产乙炔气。
(1)工业上合成CaC2主要采用氧热法。
已知:CaO(s)+3C(s)=CaC2(s)+CO(g) △H=+464.1kJ·mol-1
C(s)+l/2O2(g)=CO(g) △H=-110.5kJ.mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO,为维持热平衡,每生产l molCaC2,转移电子的物质的量为_______。
(2)已知2000℃时,合成碳化钙的过程中还可能涉及到如下反应
CaO(s)+C(s) ![]() Ca(g)+CO(g) K1 △H1=a KJ·mol-1
Ca(g)+CO(g) K1 △H1=a KJ·mol-1
Ca(g)+2C(s) ![]() CaC2(s) K2 △H2=b KJ·mol-1
CaC2(s) K2 △H2=b KJ·mol-1
2CaO(s)+CaC2(s) ![]() 3Ca(g)+2CO(g) K3 △H3=c KJ·mol-1
3Ca(g)+2CO(g) K3 △H3=c KJ·mol-1
则K1=_______ (用含K2、K3的代数式表示);c=_____(用含a、b的代数式表示)。
(3)利用电石产生乙炔气的过程中产生的H2S气体制取H2,既廉价又环保。

①利用硫化氢的热不稳定性制取氢气。在体积为2L的恒容密闭容器中,H2S起始物质的量为2mol,达到平衡后H2S的转化率![]() 随温度和压强变化如图l所示。据图计算T1℃时压强P1时,硫为气态,则平衡体系中H2的体积分数_____。由图知压强P1__P2(填“大于”“小于”或“等于”),理由是______。
随温度和压强变化如图l所示。据图计算T1℃时压强P1时,硫为气态,则平衡体系中H2的体积分数_____。由图知压强P1__P2(填“大于”“小于”或“等于”),理由是______。
②电化学法制取氢气的原理如图2,请写出反应池中发生反应的离子方程式_____,惰性电极a上发生的电极反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙可用于石油钻井,也可用于制造溴化铵及光敏纸、灭火剂、制冷剂等。制备CaBr22H2O的主要流程如下:

工业提取液溴主要采用空气吹出法,其主要流程如下:

请回答:
(1)Fe与液溴的反应温度不能超过40℃的原因是_________。
(2)试剂B最好选用_________。
(3)操作Ⅰ的步骤为蒸发浓缩、、________、洗涤、干燥。
(4)下列说法中错误的是_________。
a.滤渣A的成分可能是Fe、Fe(OH)2 、Fe(OH)3;
b.操作Ⅱ的名称是萃取
c.流程图中虚线框部分步骤的主要目的是除去杂质、富集Br2
d.成品溴中含有的少量Cl2,可加入Na2SO3溶液,然后分液除去
(5)制得的CaBr22H2O可以通过以下方法测定纯度:称取5.00 g样品溶于水,滴入足量Na2CO3溶液,充分反应后抽滤,将沉淀洗涤、烘干、冷却、称量,得到2.00 g固体。
①抽滤时用到的仪器除了安全瓶、抽气泵外,还需要_____________________________。
②抽滤中洗涤沉淀的操作方法是_________。
③以下关于抽滤的操作不正确的是________________
A.放在布氏漏斗内的滤纸大小应略小于漏斗内径,但又能将全部小孔盖住
B.过滤时,溶液量不应超过漏斗容量的2/3
C.吸滤瓶内液面将达到支管口时,应拔掉抽滤瓶上的橡皮管,从支管口处倒出溶液
D.停止吸滤时,应先拆下连接抽气泵和抽滤瓶的橡皮管,然后关闭水龙头
④测得CaBr22H2O的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5H2O和Fe3O4.
(1)基态铁原子的外围电子层排布为______________,该元素位于元素周期表中的第______________族,在水溶液中常以Fe2+、Fe3+的形式存在,其中______________更稳定.
(2)以硼酸为原料可制得NaBH4,B原子的杂化方式为______________。
(3) 第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形.RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )

A.分子中5个R-Cl键键能不都相同
B.键角(Cl-R-Cl)有90°、120、180°几种
C.RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3
D.每个原子都达到8电子稳定结构
(4)因为氯化铝易升华,其双聚物Al2Cl6结构如图1所示.1mol该分子中含______________个配位键,该分子______________(填“是”或“否”)平面型分子.
(5)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308. 8 K,主要原因是______________。
(6)二硫化碳属于_____________ (填“极性”或“非极性”)分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列各小题实验.(a、b为弹簧夹,加热及固定装置已略去)

(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
① 实验步骤:连接仪器、 、加药品后,打开a关闭b,然后滴入浓硫酸,加热;
② 铜与浓硫酸反应的化学方程式 ,装置A中的试剂是 ;
③ 能说明碳的非金属性比硅强的实验现象是 ;
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
① 在(1)②操作后打开b,关闭a ;
② H2S溶液中有浅黄色浑浊出现,化学方程式是 ;
③ BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表中相应位置。

写出其中SO2显示还原性生成沉淀的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1molL-1HCl溶液滴定10.0mL浓度为0.1molL-1Na2CO3溶液,所得滴定曲线如图所示。下列微粒浓度大小关系正确的是

A.当V=0时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-)
B.当V=5时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-)
C.当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
D.当V=a时:c(Na+)=c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体在2L的密闭容器中混合,在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)若经过2秒后测得C的浓度为0.6mol/L。
2C(g)若经过2秒后测得C的浓度为0.6mol/L。
则:(1)2s内用B表示的反应速率 。
(2)2s时A的物质的量浓度为 。
(3)2s时B的物质的量为 。
(4)最终C的浓度 (填“能”或“不能”)达到2mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入6mol/LH2SO4溶液中,乙同学将电极放入6mol/LNaOH溶液中,如图:
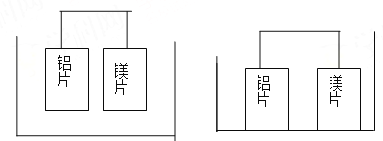
甲(H2SO4溶液) 乙(NaOH溶液)
(1)写出甲池中正极的电极反应式: ,负极的电极反应式: 。
(2)写出乙池中负极的电极反应式: ,乙池中总反应的离子方程式: 。
(3)如果甲和乙同学均认为,“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出 活动性更强,而乙会判断出 活动性更强。
(5)丙同学依据甲、乙同学的思路,设计如下实验:将铝片和铜片用导线相连.一组插入浓硝酸中,一组插入稀NaOH溶液中,分别形成了原电池。
①在这两个原电池中,负极分别为________。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
②写出插入浓硝酸中形成原电池的总反应化学方程式__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用如图所示装置研究电化学原理。下列关于该原电池的说法不正确的是

A. 原电池的总反应为 Fe+Cu2+=Fe2++Cu
B. 反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过0.2 mol电子
C. 其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-=H2↑
D. 盐桥中是 KNO3溶液,则盐桥中NO3-移向乙烧杯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com