
【题目】温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应:2NO2(g) ![]() 2NO(g)+O2(g)(正反应吸热)。实验测得:v正= v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是
2NO(g)+O2(g)(正反应吸热)。实验测得:v正= v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是

A.达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为4∶5
B.达平衡时,容器Ⅱ中![]() 比容器Ⅰ中的大
比容器Ⅰ中的大
C.达平衡时,容器Ⅲ中NO的体积分数小于50%
D.当温度改变为T2时,若k正=k逆,则 T2<T1
【答案】C
【解析】由容器I中反应2NO2 ![]() 2NO+O2
2NO+O2
起始量(mol/L) 0.6 0 0
变化量(mol/L) 0.4 0.4 0.2
平衡量(mol/L) 0.2 0.4 0.2
可以求出平衡常数K=![]() ,平衡时气体的总物质的量为0.8 mol,其中NO占0.4 mol,所以NO的体积分数为50%,
,平衡时气体的总物质的量为0.8 mol,其中NO占0.4 mol,所以NO的体积分数为50%,![]() 。在平衡状态下,v正=v(NO2)消耗=v逆=v(NO)消耗,所以k正c2(NO2)=k逆c2(NO)c(O2),进一步求出
。在平衡状态下,v正=v(NO2)消耗=v逆=v(NO)消耗,所以k正c2(NO2)=k逆c2(NO)c(O2),进一步求出![]() 。
。
A.根据容器II的起始投料,Q=![]() =
=![]() <K,平衡将向正反应方向移动,所以容器II在平衡时气体的总物质的量一定大于1 mol,故两容器的压强之比一定小于4∶5,A错误;B.若容器II在某时刻,
<K,平衡将向正反应方向移动,所以容器II在平衡时气体的总物质的量一定大于1 mol,故两容器的压强之比一定小于4∶5,A错误;B.若容器II在某时刻,![]() ,
,
由反应2NO2 ![]() 2NO + O2
2NO + O2
起始量(mol/L) 0.3 0.5 0.2
变化量(mol/L) 2x 2x x
平衡量(mol/L) 0.32x 0.5+2x 0.2+x
因为,![]() ,解之得x=
,解之得x=![]() ,求出此时浓度商Qc=
,求出此时浓度商Qc=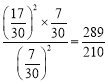 >K,所以容器II达平衡时,
>K,所以容器II达平衡时,![]() 一定小于1,B错误;C.若容器III在某时刻,NO的体积分数为50%;
一定小于1,B错误;C.若容器III在某时刻,NO的体积分数为50%;
2NO2 ![]() 2NO + O2
2NO + O2
起始量(mol/L) 0 0.5 0.35
变化量(mol/L) 2x 2x x
平衡量(mol/L) 2x 0.52x 0.35x
由0.52x=2x+0.35x,解之得,x=0.05,求出此时浓度商Qc=![]() >
>![]() ,说明此时反应未达平衡,反应继续向逆反应方向进行,NO进一步减少,所以C正确;D.温度为T2时,
,说明此时反应未达平衡,反应继续向逆反应方向进行,NO进一步减少,所以C正确;D.温度为T2时,![]() >0.8,因为正反应是吸热反应,升高温度后化学平衡常数变大,所以T2>T1,D错误。
>0.8,因为正反应是吸热反应,升高温度后化学平衡常数变大,所以T2>T1,D错误。


科目:高中化学 来源: 题型:
【题目】下列物质既能通过单质间化合反应制取,也能通过单质与盐酸反应制取的是( )
A. CuCl2 B. ZnCl2 C. FeCl3 D. FeCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自热食品已成为现代生活的时尚。自热食品包装中有两包发热剂,在这两包发热剂中最适合盛饭的物质是( )
A. 熟石灰和水 B. 生石灰和水 C. 氯化钠和水 D. 氯化铵和氢氧化钡晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列叙述正确的是
A. a g C2H4和C3H6的混合物所含原子总数为![]()
B. 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA
C. 标准状况下,22.4 L H2O含有的分子数为 NA
D. 物质的量浓度为0.5 mol·L1的MgCl2溶液中,含有Cl个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2 ,则下列说法中正确的是( )
2KClO3 + H2C2O4 + H2SO4 ![]() 2ClO2↑ + K2SO4 + 2CO2↑ + 2H2O
2ClO2↑ + K2SO4 + 2CO2↑ + 2H2O
A. KClO3在反应中是还原剂
B. 1molKClO3参加反应,在标准状况下能得到22.4L气体
C. 在反应中H2C2O4 既不是氧化剂也不是还原剂
D. 1molKClO3参加反应有1mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4 、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水回收硫酸亚铁和金属铜。请根据流程图,回答下列问题:

(1)物质X的化学式为________,操作1的名称:________
(2)写出A中主要成分的化学式:_____,在A中加入Y的离子方程式为:__________________
(3)工业废水中加入X所发生的离子方程式为:__________________________________;是否氧化还原反应____________(填“是”或“否”),如果是氧化还原反应,发生还原反应的是:______________(若非氧化还原反应则说明理由)。
(4)操作中的操作3是:___________、冷却结晶、过滤、洗涤、烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨的水溶液显弱碱性,其原因为___________________(用离子方程式表示), 0.1 molL-1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度__________(填“增大”或“减小”);
(2)25℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=___________________;
②0.10molL-1Na2SO3溶液中离子浓度由大到小的顺序为___________________;
③H2SO3溶液和NaHCO3溶液反应的离子方程式为___________________;
(3)银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。已知Ksp(AgCl)=1.8×10-10,若向5mL0.018molL-1的AgNO3溶液中加入5mL0.020molL-1的盐酸,混合后溶液中的Ag+的浓度为______molL-1,pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于取代反应的是
A. 乙烯通入酸性高锰酸钾溶液中
B. 苯与液溴混合后撒入铁粉
C. 在镍做催化剂的条件下,苯与氢气反应
D. 乙烯通入溴水中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com