


 ��ĩ��ϰ���ϵ�д�
��ĩ��ϰ���ϵ�д� ����ѧ�䵥Ԫ������ĩר����100��ϵ�д�
����ѧ�䵥Ԫ������ĩר����100��ϵ�д� �Ƹ�360�ȶ����ܾ�ϵ�д�
�Ƹ�360�ȶ����ܾ�ϵ�д� ���⿼����Ԫ���Ծ�ϵ�д�
���⿼����Ԫ���Ծ�ϵ�д� ��У���˳�̾�ϵ�д�
��У���˳�̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ӵ�س��ʱ��ط�ӦΪC6Li��Li1��xMO2==LiMO2��C6Li1��x |
| B����ط�Ӧ�У�ﮡ�п������Ǧ��ʧȥ1mol���ӣ�����������ĵ�������С |
| C������ӵ�طŵ�ʱ����ڲ�Li+���ƶ� |
| D������ӵ�س��ʱ������ӦΪC6Li1��x��xLi+��x e��==C6Li |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���������γ�ԭ��� | B��������������ΪþƬ����Ƭ |
| C��������������Ϊ��Ƭ��þƬ | D���������϶���þƬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��2Fe-4e- = 2Fe2+ | B��2Fe2++4e- = 2Fe |
| C��2H2O+O2+4e-= 4OH- | D��Fe3++e-= Fe2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����ʱ�����������ķ�Ӧ��PbSO4��s��+2e-=Pb��s��+SO42-��aq�� |
| B�����ʱ������������Ũ�Ȳ��ϱ�С |
| C���ŵ�ʱ�õ�صĸ���������Ǧ�� |
| D���ŵ�ʱ���������ķ�Ӧ�ǣ�Pb��s��+SO42-��aq��=PbSO4��s��+2e- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��п�̸ɵ����ZnΪ������̼��Ϊ���� |
| B��п�̸ɵ�ع���ʱ��������̼�������·����Zn�� |
| C��п�̸ɵ�س�ʱ������ʹ��ʱ��װ��״���������ʴ���� |
| D��п�̸ɵ���ܽ���ѧ��ת��Ϊ���ܺͽ�����ת��Ϊ��ѧ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������


 2NH3��g����H1��0��ʵ�����c��N2����ʱ�䣨t���ı仯��ͼ��ʾ��T��ʾ�¶ȣ���
2NH3��g����H1��0��ʵ�����c��N2����ʱ�䣨t���ı仯��ͼ��ʾ��T��ʾ�¶ȣ��� NH3?H2O��aq��+H����aq���Ļ�ѧƽ�ⳣ��Ϊ5.55��10��10 mol��L-1����NH3?H2O�ĵ���ƽ�ⳣ��K= ��������λ��Ч���֣���
NH3?H2O��aq��+H����aq���Ļ�ѧƽ�ⳣ��Ϊ5.55��10��10 mol��L-1����NH3?H2O�ĵ���ƽ�ⳣ��K= ��������λ��Ч���֣����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ӦCaCO3(s)=CaO(s)+CO2(g)�ڳ����²��ܷ�������÷�Ӧ�ġ�H��0 |
B��0.1 mol��L��1CH3COOH��Һ��ˮϡ�ͺ���Һ��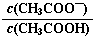 ��ֵ��С ��ֵ��С |
| C��Ǧ�����ڷŵ�����У������������ӣ������������� |
| D����¯�г�����CaSO4���ñ���Na2CO3��Һ���ݣ��ٽ���������ϡ�����ܽ��ȥ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com