
【题目】油脂是油与脂肪的总称,它是多种高级脂肪酸的甘油酯。油脂既是重要食物,又是重要的化工原料。油脂的以下用途与其含有的碳碳不饱和键(![]() )有关的是
)有关的是
A. 衣服上的油脂可用汽油洗去
B. 适量摄入油脂,有利于人体吸收多种脂溶性维生素和胡萝卜素
C. 植物油通过氢化可以制造植物奶油(人造奶油)
D. 脂肪是有机体组织里储存能量的重要物质
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】海水是重要的资源,可以制备一系列物质。
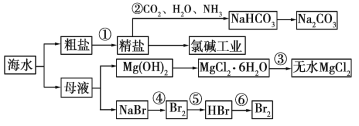
下列说法正确的是
A. 除去粗盐中 SO42-、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH 溶液→BaCl2 溶液→Na2CO3 溶液→过滤→盐酸
B. 步骤②中,应先通 CO2,再通 NH3
C. 步骤③中可将 MgCl2·6H2O 晶体在空气中直接加热脱水
D. 步骤④、⑤、⑥反应中,溴元素均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上采用如下反应合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
(1)分析该反应并回答下列问题:
①该反应的平衡常数表达式为K=____________。
②下列选项能判断该反应达到平衡状态的依据有__________(填序号)。
A.2v(正)(H2)= v(逆)(CO)
B.一定条件下,单位时间内消耗2molH2的同时生成 1mol CH3OH
C.恒温、恒容时,容器内的压强不再变化
D.恒温、恒容时,容器内混合气体的密度不再变化
E.混合气体的平均相对分子质量不随时间而变化
(2))下图是该反应在不同温度下CO转化率随时间的变化曲线:
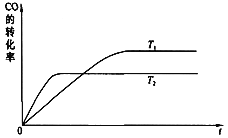
①该反应的△H________0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数:K1 ________ K2(填“>”、“<”或“=”)。
(3)某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为________________。
(4)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式________________________。
(5)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。
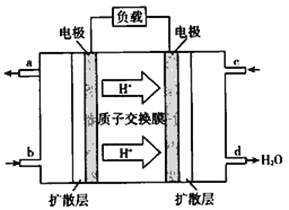
①该电池工作时,b口通入的物质为__________(填 化学式,下同),c 口通入的物质为__________。 ②该电池正极的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池结构如图所示,回答下列问题:
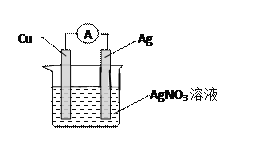
(1)铜作原电池的_______极,发生_______反应 ,电极反应式为 _____________________ ;
(2)银作原电池的_______极,发生_______反正,电极反应式为 _____________________;
(3)电子从_______经外电路流向_______,银离子向_______极移动,硝酸根离子向_______极移动(填“正极”或“负极”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于10%H2O2的分解反应,下列措施能减慢其化学反应速率的是( )
A. 加入MnO2 B. 加水稀释 C. 加热 D. 加入30%H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:△G=△H-T△S,当△G<0,反应能自发进行,△G>0反应不能自发进行。某反应2AB(g)C(g)+3D(g)在高温时能自发进行,在低温下不能自发进行,则该反应的正反应的△H、△S应为
A.ΔH<0,△S<0B.△H<0, △S>0
C.△H>0,△S<0D.△H>0,△S>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4)是有机合成的重要还原剂,其合成线路如下图所示。
![]()
(1)铝氢化钠遇水发生剧烈反应,其反应的化学方程式为__________________________。
(2)AlCl3与NaH反应时,需将AlCl3溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因是__________________________________________。
(3)实验室利用下图装置制取无水AlCl3。
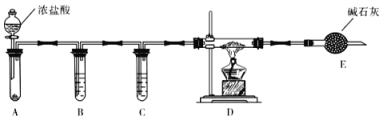
①A中所盛装的试剂是_______________。
②点燃D处酒精灯之前需排除装置中的空气,其操作是____________________________
(4)改变A和D中的试剂就可以用该装置制取NaH,若装置中残留有氧气,制得的NaH中可能含有的杂质为____________ 。
(5)现设计如下四种装置,测定铝氢化钠粗产品(只含有NaH杂质)的纯度。
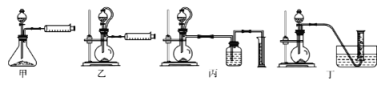
从简约性、准确性考虑,最适宜的装置是_________(填编号)。称取15.6g样品与水完全反应后,测得气体在标准状况下的体积为22.4L,样品中铝氢化钠的质量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图。
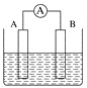
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_____(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式____
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。写出B电极反应式___,该电池在工作时,A电极的质量将___(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为___。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:_____;该电池在工作一段时间后,溶液的碱性将_____(填“增强”“减弱”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com