
【题目】下列关于有机化合物的认识不正确的是( )
A. 二氯甲烷没有同分异构体
B. 油脂在空气中完全燃烧转化为水和二氧化碳
C. 1 mol乙烯与氯气完全加成,然后再与氯气发生取代反应,最多需要6 mol Cl2
D. 在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】下列关于铁及其化合物的说法正确的是
A.赤铁矿的主要成分是Fe3O4
B.除去FeCl2 溶液中的FeCl3杂质可以向溶液中加锌粉,然后过滤
C.磁铁矿粉末溶于盐酸后,加入KSCN溶液,溶液变红色
D.Fe3O4俗称铁红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是 ( )
A.钠和冷水反应 Na+2H2O=Na++2OH+H2↑
B.金属铝溶于氢氧化钠溶液 Al+2OH=AlO2+H2
C.铁锈溶于盐酸中:Fe2O3+6H+=2 Fe 3++3H2↑
D.铁跟稀硫酸反应:Fe+2H+=Fe2++H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量。他们设计如下实验装置(如图),请你参与探究,并回答问题:
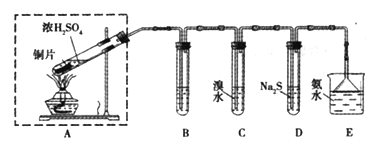
(1)装置E中的氨水可吸收少量多余的SO2,发生反应的离子方程式是____________,E装置中使用倒立的漏斗的目的是________________。
(2)装置B用于检验SO2的漂白性,其中所盛试剂为____________________,装置D用于检验SO2的______________性质;
(3)装置C中发生反应的离子方程式为_______________;
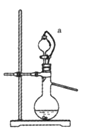
(4)如果用硫酸和亚硫酸钠反应制取二氧化硫,装置如图所示。其中a导管的作用是_______,写出烧瓶中反应的化学方程式 ___________________。
(5)他们拟用以下方法(如图)测定空气中SO2含量(假设空气中无其他还原性气体)。
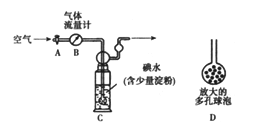
方案1:
① 洗气瓶C中溶液蓝色消失后,若没有及时关闭活塞A,则测得的SO2含量______(填“偏高”、“偏低”或“无影响”)。
方案Ⅱ:
![]()
② 实验中若通过的空气的体积为33.6L(已换算成标准状况),最终所得固体质量为0.233g,试通过计算确定该空气中二氧化硫的体积百分含量____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是( )
A.SO2具有氧化性,可用于漂白纸浆
B.NH4HCO3受热易分解,可用作氮肥
C.Fe2(SO4)3易溶于水,可用作净水剂
D.Al2O3熔点高,可用作耐高温材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学利用如图所示装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约1 min后鼓入空气。


请回答下列问题:
(1)实验时,常常将甲装置浸入70~80 ℃的水浴中,目的是___________________;由于装置设计上的缺陷,实验进行时可能的情况:__________________________。
(2)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。解释鼓气速度过快,反应体系温度反而下降的原因:_______________________________________。
(3)如何检验丙中生成的物质中有醛类物质:______________________________。
(4)在检验生成物的过程中,一位同学很偶然地发现向溴水中加入乙醛溶液,溴水褪色。针对溴水褪色的原因,该小组的同学们经过分析后,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。
请你设计一个简单的实验,探究哪一种猜想正确?__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是_________,基态D原子价电子的轨道表达式为____________。
(2)DA2分子的VSEPR模型是____________。H2A比H2D熔沸点高得多的原因是____________。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6 在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
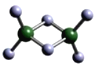
① C2Cl6属于____________晶体(填晶体类型),其中C原子的杂化轨道类型为____________杂化。
② [C(OH)4]-中存在的化学键有___________。
(4)工业上制备B的单质是电解熔融B的氯化物,而不是电解BA,原因是_____________。
(5)B、C的氟化物晶格能分别是2957 kJ·mol-1、5492 kJ·mol-1,二者相差很大的原因是____________。
(6)D与E所形成化合物晶体的晶胞如图所示。
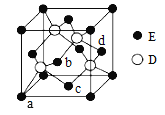
① 在该晶胞中,E的配位数为______________。
② 已知该晶胞的密度为ρ g/cm3,则其中两个D原子之间的距离为_________ pm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,能大量共存的离子组是
A. 遇酚酞试剂变红的溶液:K+、Cu2+、NO3-、SO42-
B. 遇紫色石蕊试剂变红的溶液:K+、Na+、Cl-、CO32-
C. 常温下pH<7的溶液:Ba2+、NH4+、NO3-、Cl-
D. 无色透明溶液中:K+、Na+、MnO4-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com