
| A��a����ˮ�������c��H+��=1.0��10-14mol?L-1 |
| B��b�㣺c��NH4+��+c��NH3?H2O��=c��Cl-�� |
| C��c�㣺c��Cl-��=c��NH4+�� |
| D��d�����Һ�¶����½�����Ҫԭ����NH3?H2O�������� |


 �ܿ�����ĩ��̾�ϵ�д�
�ܿ�����ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�����з�����2012�������ѧ����ĩ���в��Ի�ѧ���� ���ͣ�021
|
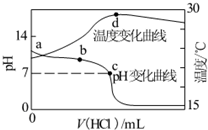
�����£���1.000 mol��L��1�������20.00 mL��1.000 mol��L��1��ˮ�У���ҺpH���¶��������������仯��������ͼ��ʾ�������й�˵����ȷ����
| |
A�� |
a����ˮ�������c(H+)��1.0��10��14 mol/L |
B�� |
a��b֮����ܳ��֣�c(NH3��H2O)��c(NH4+)��c(OH��)��c(Cl��)��c(H+) |
C�� |
c�㣺c(Cl��)��c(NH4+) |
D�� |
d�����Һ�¶����½�����Ҫԭ����NH3��H2O�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���Ϻ��г�����2012�������ѧ����ĩ������⻯ѧ���� ���ͣ�021
|
�����£���1.000 mol��L��1�������20.00 mL��1.000 mol��L��1��ˮ�У���ҺpH���¶��������������仯��������ͼ��ʾ�������й�˵����ȷ����
| |
A�� |
a����ˮ�������c(H+)��1.0��10��14 mol/L |
B�� |
b�㣺c(NH4+)��c(NH3��H2O)��c(Cl��) |
C�� |
c�㣺c(Cl��)��c(NH4+) |
D�� |
d�����Һ�¶����½�����Ҫԭ����NH3��H2O�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�긣��ʡ�����ڶ����¿���ѧ�Ծ� ���ͣ�ѡ����
�����£���1.000 mo1/L�������20.00mL l��000 mol/L
��ˮ�У���ҺpH���¶��������������仯��������ͼ��
ʾ�������й�˵����ȷ���ǣ� ��

A��a����ˮ�������c(H+��=1.0��l0-14mol/L
B��b�㣺c��NH4+��+c��NH3��H2O��=c��CI����
C��c�㣺c��Cl����= c��NH4+��
D��d�����Һ�¶����½�����Ҫԭ����NH3��H2O��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����£���1.000 mo1/L�������20.00mL l��000 mol/L
��ˮ�У���ҺpH���¶��������������仯��������ͼ��
ʾ�������й�˵����ȷ���ǣ� ��
A��a����ˮ�������c(H+��=1.0��l0-14mol/L
B��b�㣺c��NH4+��+c��NH3��H2O��=c��CI����
C��c�㣺c��Cl����= c��NH4+��
D��d�����Һ�¶����½�����Ҫԭ����NH3��H2O��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012�츣��ʡ����˫ʮ��ѧ�����ڶ����¿���ѧ�Ծ� ���ͣ���ѡ��
�����£���1.000 mo1/L�������20.00mL l��000 mol/L
��ˮ�У���ҺpH���¶��������������仯��������ͼ��
ʾ�������й�˵����ȷ���ǣ� ��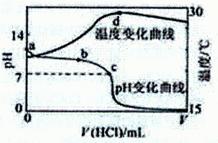
| A��a����ˮ�������c(H+��=1.0��l0-14mol/L |
| B��b�㣺c��NH4+��+c��NH3��H2O��=c��CI���� |
| C��c�㣺c��Cl����= c��NH4+�� |
| D��d�����Һ�¶����½�����Ҫԭ����NH3��H2O�������� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com