
【题目】碳、 氮、磷、砷和硼的相关化合物在化工、医药、农药、材料等领域有着广泛的应用。锂、钠、铝、铁等金属在日常生活、工业生产中也占有举足轻重的地位,请回答下列问题:
(1)基态As原子的电子排布式为______________________;
(2)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中B—N—B之间的夹角是___________________(填角度)。
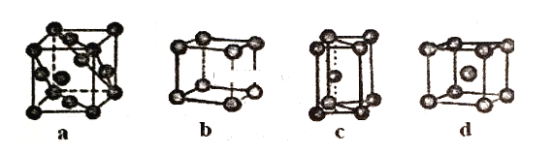
(3)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为___ (填字母)。
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】发展“碳一化学”,开发利用我国丰富的煤炭资源具有重要的战略意义和经济价值。请回答下列问题:
(1)已知:常温下C(s)的燃烧热△H=-393.5 kJ·mol-1, S(s)的燃娆热△H=-296.0 kJ·mol-l ,CO2(g)+C(S)=2CO(g) △H=+172.5 kJ·mol-1,写出一氧化碳将二氧化硫还原为单质硫的热化学方程式:______
(2)在763 K、3.04×104 kPa时,用CO和H2做原料合成甲醇(CH3OH),存在下列平衡:CO(g)+2H2(g) ![]() CH3OH(g)。当原料中CO和H2的比例不同时,对CO的转化率及平衡混合物中甲醇的体积分数都有影响。
CH3OH(g)。当原料中CO和H2的比例不同时,对CO的转化率及平衡混合物中甲醇的体积分数都有影响。
①设H2和CO起始物质的量之比为m,平衡时CO的转化率为α,平衡混合物中甲醇的体积分数为y,则m、α、y三者的关系式为y=___。
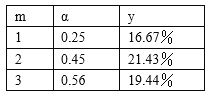
②根据表中提供的数据,可得出反应物的比例对CO的平衡转化率以及平衡混合物中甲醇的体积分数影响的结论,选择最佳反应物配比m=_______(填“l”、“2”或“3”),理由是_________。
(3)如图是四种金属氧化物被一氧化碳还原,反应达到平衡时lgc(CO)/c(CO2)与温度(T)的关系曲线图:

①8000C时,其中最易被还原的金属氧化物是______(填化学式),该反应的平衡常数K=_______。
②CO2还原PbO2的反应△H ___0(填“>”或“<”)。判断依据是_________。
(4)科学家正在研究用固态物质作为火箭推进剂。固体推进剂(硝酸钾和蔗糖的混合物)点燃后在燃烧室里燃烧,发生反应KNO3+C12H22O11→CO2↑+N2↑+H2O+K2CO3,(未配平)。则该反应中氧化剂与还原剂的物质的量之比是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下各种说法:
①金属和非金属化合时一定形成离子键;
②离子键是阳离子、阴离子的相互吸引力;
③根据电离方程式HCl![]() H++Cl-,判断氯化氢分子里存在离子键;
H++Cl-,判断氯化氢分子里存在离子键;
④氢气和氯气的反应过程:H2、Cl2分子里共价键发生断裂生成H原子、Cl原子,而后H原子、Cl原子形成离子键的过程
上述各种说法正确的是
A. ①② B. 都不正确 C. ①②④ D. ①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的一种同位素X的原子质量数为A,含N个中子,它与![]() 原子组成HmX分子.在a克HmX中所含质子的物质的量是( )
原子组成HmX分子.在a克HmX中所含质子的物质的量是( )
A. ![]() (A-N+m)molB.
(A-N+m)molB. ![]() (A-N)molC.
(A-N)molC. ![]() (A-N)molD.
(A-N)molD. ![]() (A-N+m)mol
(A-N+m)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰干电池是最早的实用电池。现用下列工艺回收正极材料中的金属(部分条件未给出)。

(1)碱性锌锰电池反应为:Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH),电解质是KOH, MnO(OH)中Mn的化合价为:_____,正极反应式为:__________。
(2)黑粉的主要成份为 MnO2和石墨,写出反应①的化学方程式:________
(3)MnO2的转化率与温度的关系如下表:
温度/℃ | 20 | 40 | 60 | 80 | 100 |
转化率/℃ | 86.0 | 90.0 | 91.3 | 92.0 | 92.1 |
生产中常选反应温度为80℃,其理由是:___________。
(4)“沉锰”过程中生成碱式碳酸锰[MnCO36Mn(OH)25H2O],写出其离子反应方程式:_______。滤液③中可回收的物质为:________(填化学式)。
(5)用硫酸酸化的![]() 浆液可吸收工业废气中的
浆液可吸收工业废气中的![]() 生成
生成![]() ,已知浆液中
,已知浆液中![]() 含量为
含量为![]() ,工业废气中
,工业废气中![]() 含量为
含量为![]() ,
, ![]() 的吸收率可达90%,则处理1000
的吸收率可达90%,则处理1000![]() 工业尾气,可得到
工业尾气,可得到![]() 的质量为____kg(用含字母的代数式表示)。
的质量为____kg(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钨晶体晶胞的结构模型如下图所示。实验测得金属钨的密度为19.30![]() 已知钨的相对原子质量为183.8。回答下列问题:
已知钨的相对原子质量为183.8。回答下列问题:
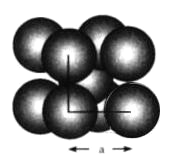
(1)在钨晶体中每个晶胞占有的钨原子数为__________个。
(2)钨晶体晶胞的边长为![]() __________
__________![]() 。
。
(3)钨原子的半径为__________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.铜粉加入氯化铁溶液中:Cu + Fe3+ = Fe2++Cu2+
B.将稀硫酸滴在铜片上:Cu + 2H+ =Cu2++ H2↑
C.氯气与烧碱溶液反应:Cl2+2OH-=ClO-+Cl-+H2O
D.将少量铜屑放入稀硝酸中:Cu+4H++2NO![]() = Cu2++2NO2↑+2H2O
= Cu2++2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为_____________。
(2)由A、B、W三种元素组成的18电子微粒的电子式为______________。
(3)若要比较D与E的金属性强弱,下列实验方法可行的是____________。
A. 将单质D置于E的盐溶液中,若D不能置换出单质E,说明D的金属性弱
B. 比较D和E的最高价氧化物对应水化物的碱性,前者比后者强,故前者金属性强
C. 将D、E的单质分别投入到同浓度的盐酸中,观察到D反应更剧烈,说明D的金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1 mol·L-1 NaOH溶液滴定40 mL 0.1 mol·L-1 H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述错误的是( )
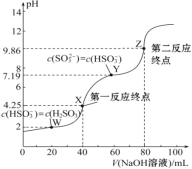
A. Ka2(H2SO3)的数量级为10-8
B. 若滴定到第一反应终点,可用甲基橙作指示剂
C. 图中Z点对应的溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)
D. 图中Y点对应的溶液中:3c(SO32-)=c(Na+)+c(H+)-c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com