
卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂.下列对于过氧化钙(CaO2)的叙述错误的是( )
|
| A. | CaO2具有氧化性,对面粉可能具有增白作用 |
|
| B. | CaO2中阴阳离子的个数比为1:1 |
|
| C. | CaO2和水反应时,每产生1mol O2转移电子4mol |
|
| D. | CaO2和CO2反应的化学方程式为:2CaO2+2CO2=2CaCO3+O2 |
考点:
氧化还原反应.
专题:
氧化还原反应专题.
分析:
A、依据过氧化钠的性质推断过氧化钙的性质可能具有漂白性;
B、依据过氧化钙构成离子是钠离子和过氧根离子分析;
C、依据CaO2和水反应的化学方程式分析计算;
D、依据过氧化钠性质推断过氧化钙与二氧化碳的反应;
解答:
解:A、结合过氧化钠的性质推断,CaO2具有氧化性,可能具有漂白性,对面粉可能具有增白作用,故A正确;
B、过氧化钙构成离子是钠离子和过氧根离子,CaO2中阴阳离子的个数比为1:1,故B正确;
C、CaO2和水反应的化学方程式为2CaO2+2H2O=2Ca(OH)2+O2↑,每产生1molO2转移电子2mol,故C错误;
D、CaO2和CO2反应的化学方程式为:2CaO2+2CO2=2CaCO3+O2;故D正确;
故选C.
点评:
本题考查了过氧化物性质的推断应用,依据过氧化钠的性质分析类推过氧化钙的性质是解题关键.


科目:高中化学 来源: 题型:
在1.01KPa和298K条件下,2molH2生成水蒸汽放出484kJ热量,下列热化学方程式正确的是( )
A. 2H2(g)+O2(g)=2H2O(l);△H=﹣484kJ/mol
B. H2O(g)=H2(g)+ O2(g);△H=﹣242kJ/mol
O2(g);△H=﹣242kJ/mol
C. 2H2(g)+O2(g)=2H2O(g);△H=+484kJ/mol
D. H2(g)+ O2(g)=H2O(g);△H=﹣242kJ/mol
O2(g)=H2O(g);△H=﹣242kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组在家中进行化学实验,按照图甲连接好线路后发现灯泡不亮,按照图乙连接好线路后发现灯泡亮,由此得出的结论正确的是( )

A.NaCl是非电解质
B.NaCl溶液是电解质
C.NaCl是弱电解质
D.NaCl在水溶液中电离出了可以自由移动的离子
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化铁溶液与氢氧化铁胶体具有的共同性质是( )
|
| A. | 分散质颗粒直径都在l~100nm之间 |
|
| B. | 能透过半透膜 |
|
| C. | 加热蒸干、灼烧后都有氧化铁生成 |
|
| D. | 呈红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据表中信息,判断下列叙述中正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | Cl﹣ | |
| ② | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| ③ | KClO3 | 浓盐酸 | / | Cl2 |
|
| A. | 表中①组反应可能有一种或两种元素被氧化 |
|
| B. | 氧化性强弱比较:KClO3>Cl2>Fe3+>Br2 |
|
| C. | 表中②组反应的离子方程式是2MnO4﹣+3H2O2+6H+═2Mn2++4O2↑+6H2O |
|
| D. | 表中③组反应的还原产物是KCl,电子转移数目是6e﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液,其中有可能存在离子如下:Na+、Ba2+、Al3+、A1O2﹣、S2﹣、SO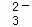 、SO
、SO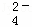 .现取该溶液进行有关实验,实验结果如图所示.
.现取该溶液进行有关实验,实验结果如图所示.

请回答下列问题:
(1)沉淀甲是
(2)沉淀乙是 由溶液甲生成沉淀乙的离子方程式为:
(3)沉淀丙是
(4)写出生成甲的离子方程式
(5)综合上述信息,可以肯定存在的离子 .
查看答案和解析>>
科目:高中化学 来源: 题型:
0.01mol氯化铬(CrCl3•6H2O)在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此氯化铬最可能是( )
|
| A. | [Cr(H2O)6]Cl3 | B. | [Cr(H2O)5Cl]Cl2 |
|
| C. | [Cr(H2O)4Cl2]Cl•2H2O | D. | [Cr(H2O)3Cl3]•3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为5L的密闭容器中,通入5mol N2和8mol H2,在一定条件下反应生成NH3,当反应进行到2min时,测得容器内有4mol NH3.则:
(1)2min时,容器内n(N2)= ,c(H2)= .
(2)2min内,以N2表示的平均反应速率v(N2)= .
(3)2min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下表给出14﹣17号元素的一些性质,请回答:
| 14Si | 15P | 16S | 17Cl | |
| 单质与H2 反应的条件 | 高温 | 磷蒸气与 H2能反应 | 加热 | 光照或点燃 时发生爆炸 |
| 最高价氧化 物的水化物 | H4SiO4 弱酸 | H3PO4 中强酸 | H2SO4 强酸 | HClO4 最强含氧酸 |
(1)它们所形成的氢化物中稳定性最差的是 ,还原性最差的是 .
(2)四种元素的非金属性随着元素原子序数的递增而逐渐 ,试从原子结构的角度加以解释 .
(3)一定条件下,反应H2S+Cl2=2HCl+S能否发生?简述理由. .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com