
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是

A.①代表滴加H2SO4溶液的变化曲线
B.b点溶液中大量存在的离子是Na+、OH–
C.c点两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源:2016-2017学年甘肃省高二上第一次月考化学卷(解析版) 题型:选择题
据报道,某国一集团拟在太空建造巨大的激光装置,把太阳光变成激光用于分解海水制氢:2H2O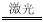 2H2↑+O2↑下列说法正确的是 ( )
2H2↑+O2↑下列说法正确的是 ( )
①水的分解反应是放热反应 ②氢气是一级能源 ③使用氢气作燃料有助于控制温室效应
④若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可以改善生存环境
A.①② B.②③ C.①③ D.③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高二上第一次月考化学卷(解析版) 题型:选择题
下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3kJ/mol,则甲烷燃烧热的热化学方程式可表示为:
CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H=-890.3kJ/mol
B.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),
放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H=-38.6kJ/mol
2NH3(g)△H=-38.6kJ/mol
C.NaOH(aq)+1/2H2SO4(浓)═1/2Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol
D.2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体,放出99.6kJ的热量,该反应的热化学方程式为:
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H=-2589.6kJ/moL
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高二上第一次月考化学卷(解析版) 题型:选择题
下列事实中,与电化学腐蚀无关的是
A.镀锡的铁制品,镀层部分受损后,露出的铁表面易被腐蚀
B.在空气中,光亮的银器表面逐渐变暗
C.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
D.为保护海轮的船壳,常在船壳上镶入锌块
查看答案和解析>>
科目:高中化学 来源:2017届山东省新泰市高三上学期第一次阶段考化学试卷(解析版) 题型:选择题
滴加新制氯水后,下列各组离子可能大量存在的是( )
A.Fe3+、Al3+、Cl-、NO3— B.K+、Na+、I-、SO42—
C.Ag+、Ca2+、NH4+、、NO3— D.Na+、Ba2+、CO32—、SO42—
查看答案和解析>>
科目:高中化学 来源:2017届山东省新泰市高三上学期第一次阶段考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.Na2O、Na2O2组成元素相同,且与CO2反应的产物相同
B.2Na2O2+2H2O 4NaOH+O2↑中Na2O2是氧化剂,H2O是还原剂
4NaOH+O2↑中Na2O2是氧化剂,H2O是还原剂
C.Na2O2溶于水产生O2的离子方程式为Na2O2+H2O 2Na++2OH-+O2↑
2Na++2OH-+O2↑
D.Na2O2用作呼吸面具的供氧剂时氧元素既被氧化又被还原
查看答案和解析>>
科目:高中化学 来源:2017届山东省高密市高三上学期10月统考化学试卷(解析版) 题型:填空题
硫的化合物再生产和生活中有广泛的应用,其吸收和处理及相互转化具有广泛的意义
(1)二氧化硫具有还原性,可以和许多氧化剂反应,二氧化硫气体通入硫酸酸化的重铬酸钾溶液中,恰好生成铬钾钒[ KCr(SO4)2.12H2O],写出反应的化学方程式反应中被还原的元素
(2)过量二氧化硫通入硫化钠溶液可以看到黄色沉淀,产物还有一种盐,写出反应的离子方程式
(3)在1L0.3mol/L的氢氧化钠溶液中,通入4.48L二氧化硫(标况)反应后得到的溶液中微粒的浓度之间有一些等量关系: 任写一个
(4)燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。SO2烟气脱除的一种工业流程如下:

① 用纯碱溶液吸收SO2将其转化为HSO3-,反应的离子方程式是 。
② 若石灰乳过量,将其产物再排回吸收池,其中可用于吸收SO2的物质的化学式是 。
查看答案和解析>>
科目:高中化学 来源:2017届山东省高密市高三上学期10月统考化学试卷(解析版) 题型:选择题
在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25℃时反应Ni(CO)4(g)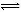 Ni(s)+4CO(g)的平衡常数为2×10-5
Ni(s)+4CO(g)的平衡常数为2×10-5
C.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v(正)>v(逆)
D.80℃达到平衡时,测得n(CO)=0.15mol,则Ni(CO)4的平衡浓度为0.125 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东实验中学顺德学校高二上阶段质检化学试卷(解析版) 题型:选择题
已知:① Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=+489.0 kJ·mol-1
② CO(g)+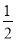 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
③ C(石墨)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
则4Fe(s)+3O2(g)=2Fe2O3(s)的ΔH为( )
A.+1 164.1 kJ·mol-1 B.-1 641.0 kJ·mol-1
C.-259.7 kJ·mol-1 D.-519.4 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com