
| A. | 用食醋可除去热水壶内壁的水垢 | |
| B. | 淀粉,油脂 和蛋白质都是高分子化合物 | |
| C. | 服用铬含量超标的药用胶囊会对人对健康造成危害 | |
| D. | 新型复合材料使手机、电脑等电子产品更轻巧、实用和新潮 |
分析 A.醋酸能和碳酸钙反应生成可溶性的醋酸钙;
B.油脂属于小分子化合物;
C.药用胶囊超标的铬,是重金属盐,能使蛋白质发生变性;
D.新型复合材料具有强度大、刚度好、重量轻等特点特点,可以制造出具有较好性价比的特殊结构的产品.
解答 解:A.水垢的主要成分是碳酸钙,碳酸的酸性小于醋酸的酸性,醋酸能和不溶性的碳酸钙反应生成可溶性的醋酸钙,所以用食醋可除去热水壶内壁的水垢,故A正确;
B.淀粉和蛋白质属于天然高分子化合物,油脂的相对分子质量较小,属于小分子化合物,故B错误;
C.铬是重金属,能使蛋白质发生变性,服用铬含量超标的药用胶囊会对人体健康造成危害,故C正确;
D.新型复合材料具有强度大、刚度好、重量轻等特点特点,所以新型复合材料使手机、电脑等电子产品更轻巧,实用和新潮,故D正确.
故选B.
点评 本题考查了物质的性质、高分子化合物、蛋白质的性质以及复合材料等知识点,难度不大,学习中注意相关基础知识的积累.


科目:高中化学 来源: 题型:解答题
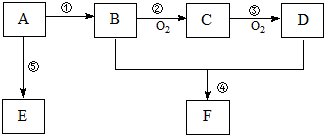
 ,B中官能团的名称为羟基.
,B中官能团的名称为羟基. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
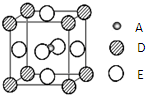 已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的原子序数为28.
已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的原子序数为28.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
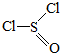 )主要用于制造酰基氯化物,其工业制备原理:
)主要用于制造酰基氯化物,其工业制备原理:| A. | SCl2和SOCl2中S的化合价分别为+2、+4价 | |
| B. | 制备反应中,二氧化硫是氧化产物 | |
| C. | 每消耗1mol SCl2,转移1mol电子 | |
| D. | SOCl2分子中既含有离子键又含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
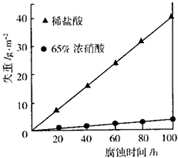 按要求回答下列问题:
按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol | B. | 0.4mol | C. | 0.6mol | D. | 0.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
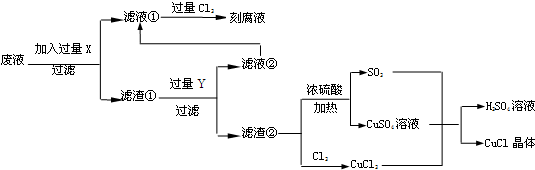
| 1 | 2 | 3 | |
| 0.25克样品消耗硫酸铈标准溶液的体积(mL) | 23.85 | 24.35 | 23.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
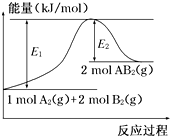 已知某化学反应A2(g)+2B2(g)═2AB2(g)(AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是( )
已知某化学反应A2(g)+2B2(g)═2AB2(g)(AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是( )| A. | 该反应的进行一定需要加热 | |
| B. | 该反应的△H=-(E1-E2)kJ/mol | |
| C. | 该反应中反应物的键能总和大于生成物的键能总和 | |
| D. | 断裂1 mol A-A和2 mol B-B放出E1 kJ能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com