
(8分)
在一定体积的密闭容器中,进行如下化学方程式:
CO(g)+H2O(g)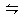 CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.5 |
回答下列问题:
(1)该反应化学平衡常数的表达式为K= 。
(2)该反应为 (填“放热”或“吸热”)反应。
(3)能判断该反应是否达到化学平衡状态的依据是 。
A.容器中压强不变 B.混合气体中c(CO)不变
C.υ(正,H2)=υ(逆,H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O)。试判断此时的温度为 ℃。
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源:2016届吉林省高三上学期第一次模拟化学试卷(解析版) 题型:实验题
(15分)目前,回收溴单质的方法主要有水蒸气蒸馏法和萃取法等。某兴趣小组通过查阅相关资料拟采用如下方案从富马酸废液(含溴0.27%)中回收易挥发的Br2:

(1)操作X所需要的主要玻璃仪器为 ;反萃取时加入20%的NaOH溶液,其离子方程式为 。
(2)反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是: 。
(3)溴的传统生产流程为先采用氯气氧化,再用空气水蒸气将Br2吹出。与传统工艺相比,萃取法的优点是 。
(4)我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00mg/L。实验室可用一定浓度的溴水测定某废水中苯酚的含量,其原理如下:

①请完成相应的实验步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中。
步骤2:将4.5 mL 0.02mol/L溴水迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中加入过量的0.1mol/L KI溶液,振荡。
步骤4: ,再用0.01 mol/L Na2S2O3标准溶 液滴定至终点,消耗 Na2S2O3溶液15 mL。(反应原理:I2 + 2Na2S2O3 = 2NaI + Na2S4O6)
液滴定至终点,消耗 Na2S2O3溶液15 mL。(反应原理:I2 + 2Na2S2O3 = 2NaI + Na2S4O6)
步骤5:将实验步骤1~4重复2次。
②该废水中苯酚的含量为 mg/L。
③步骤3若持续时间较长,则测得的废水中苯酚的含量 。(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2016届山东省南校区高三上学期10月阶段测化学试卷(解析版) 题型:选择题
对下列实验的描述不正确的是

A.图(a)所示的实验:根据检流计(G)中指针偏转的方向比较Zn、Cu的金属活泼性
B.图(b)所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀
C.图(c)所示的实验:根据温度计读数的变化用稀盐酸和稀NaOH溶液反应测定中和热
D.图(d)所示的实验:根据两烧瓶中气体颜色的变化判断2NO2(g)? N2O4(g)是放热反应
查看答案和解析>>
科目:高中化学 来源:2016届湖南省常德市高三上学期第三次月考化学试卷(解析版) 题型:填空题
(8分)(1)光导纤维的主要成分是_________(填化学式)。碱性溶液不能用带玻璃塞的试剂瓶盛装的原因是(用离子方程式说明)______________。
(2)漂白粉的有效成分是_______________(填物质名称),其漂白原理是(用化学方程式表示)___________。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期10月月考化学试卷(解析版) 题型:推断题
某科研小组利用石油分馏产品经下列路线,合成一种新型香料。

已知X分子中碳氢质量比为24:5,A、E都是X的裂解产物,且二者互为同系物,D与饱和NaHCO3溶液反应产生气体。
(1)X分子为直链结构,X的名称为________________;C中官能团的名称为_______________。
(2)①~⑥的反应中,下列反应类型存在且数目由多到少的是______________。(用字母和“>”写出)
A.加成反应 B.加聚反应 C.取代反应 D.氧化反应
(3)B与D在浓硫酸作用下,生成甲,则与甲同类别的同分异构体的有__________种(不包括甲)
(4)写出⑥的化学反应方程式______________________________。
(5)E可能发生下列选项中的某种反应,写出能反应的化学方程式___________________________。
A.皂化反应 B.与乙酸的酯化反应 C.加聚反应 D.与银氨溶液的银镜反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔高二上10月月考化学试卷(解析版) 题型:选择题
已知热化学方程式C2H2(g)+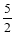 O2(g)=2CO2(g)+H2O(g);△H=-1256kJ/mol,下列说法正确的是
O2(g)=2CO2(g)+H2O(g);△H=-1256kJ/mol,下列说法正确的是
A. 乙炔的燃烧热为1256kJ/mol
B. 若转移10mol电子,则消耗2.5mol O2
C. 若生成2mol液态水,则△H=-2512kJ/mol
D. 若形成4mol碳氧共用电子对,则放出的热量为2512kJ
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔高一上10月月考化学试卷(解析版) 题型:选择题
有一种气体的质量是14.2g,体积是4.48升(标况),该气体的摩尔质量是
A.28.4 B.28.4g·mol-1 C.71 D.71g·mol-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上学期9月月考化学试卷(解析版) 题型:选择题
在298 K、100 kPa时,已知:①2H2O(g)===O2(g)+2H2(g)ΔH1
②Cl2(g)+H2(g)===2HCl(g)ΔH2
③2Cl2(g)+2H2O(g)===4HCl(g)+O2(g)ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
查看答案和解析>>
科目:高中化学 来源:2016届江西省南昌市高三上学期第一次月考化学试卷(解析版) 题型:填空题
(8分)某铁矿石(只含金属氧化物和SiO2)溶于过量盐酸后,过滤所得滤液可用来制氧化铁涂料。
(1)向上述滤液中可加入 来证明含有Fe2+。
A.酸性KMnO4溶液 B.NaOH溶液 C.溴水 D.KSCN溶液+氯水
(2)若某铁矿石的质量为3.31g,溶于适量盐酸后,然后加过量碱溶液,生成沉淀,再灼烧沉淀,得2.40g Fe2O3.已知该铁矿石中铁的氧化物的质量分数为70%.试计算:
①该铁矿石中铁的质量分数 ②该铁矿石中铁的氧化物的化学式
(3)若滤液为1L AlCl3和FeCl3混合溶液,向其中加入含a mol NaOH的溶液时,产生的沉淀量可达最大值;继续加入NaOH溶液,沉淀开始溶解,当前后加入的NaOH总量达到b mol时,沉淀不再减少,则原溶液中Fe3+的物质的量浓度为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com