
| A. | 该反应属于置换反应 | B. | 氧化性I2>KClO3 | ||
| C. | 还原性KClO3>I2 | D. | 还原剂为I2,氧化剂为Cl2 |
分析 2KClO3+I2=2KIO3+Cl2中I元素的化合价升高,Cl元素的化合价降低,以此来解答.
解答 解:A.为单质与化合物反应生成新单质、化合物的反应,属于置换反应,故A正确;
B.由氧化剂的氧化性大于氧化产物的氧化性可知,氧化性为KClO3>KIO3,氧化剂的氧化性大于还原剂的氧化性,则KClO3>I2,故B错误;
C.还原性的还原性强,则还原性为KClO3<I2,故C错误;
D.I元素的化合价升高,Cl元素的化合价降低,则还原剂为I2,氧化剂为KClO3,故D错误;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意基本概念及氧化性、还原性比较,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Fe2+、Cl-、NO3- | B. | CO32-、SO42-、Na+、K+ | ||
| C. | Cl-、MnO4-、OH-、K+ | D. | Mg2+、SO42-、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | l mol任何气体的体积都约是22.4L | |
| B. | l mol任何物质在标准状况下所占体积都约是22.4L | |
| C. | 不同的气体,体积相同,它们所含的分子数可能不同 | |
| D. | 在同温同压下,相同质量的氯气和氢气体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 范德华力、范德华力、范德华力 | B. | 范德华力、范德华力、共价键 | ||
| C. | 范德华力、共价键、共价键 | D. | 共价键、共价键、共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ③④⑤ | C. | ①②④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滤液中一定有Fe2(SO4)3和FeSO4 | |
| B. | 滤液中可能有CuSO4,一定有FeSO4、ZnSO4 | |
| C. | 滤渣中一定有Cu和Fe,一定无Zn | |
| D. | 滤渣中可能有Cu、Fe和Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
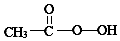 )常用作纺织品漂白剂.
)常用作纺织品漂白剂.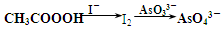
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com