
下列关于晶体的说法一定正确的是( )
A.第ⅠA碱金属元素与ⅦA元素所形成的化合物在固态时为离子晶体,晶体中阴、阳离子排列方式相同
B.晶体中存在阴离子就必定存在阳离子,存在阳离子就必定存在阴离子
C.离子晶体中只含有离子键,分子晶体、原子晶体中必定含有共价键
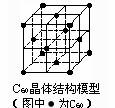
D.C60晶体(其结构模型如右图)中每个C60分子周围与它距离最近且等距离的C60分子有12个
科目:高中化学 来源: 题型:

A.由于铁桶表面有一层致密的氧化膜,所以工业生产中常常用铁桶来盛装稀硫酸
B.家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中发生的化学反应是:2H2O+O2+4e-![]() 4OH-和Fe-3e-
4OH-和Fe-3e-![]() Fe3+
Fe3+
C.Fe2+是人体血液中不可缺少的一种离子,所以血液中Fe2+的含量越高越好
D.上述纯铁晶体转变温度(1183 K以下和以上)前后两者的密度比为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分) 水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。根据下列信息回答问题:
(1)基态氧原子价层电子的电子排布图为____________
(2)写出两种与H2O分子互为等电子体的微粒 、
(3)下列关于水的说法正确的是__________(选填序号)。
A、纯水呈中性,所以在任何条件下纯水的pH均为7;
B、水分子是由极性键构成的极性分子;
C、水在化学反应中可以作氧化剂,也可以作还原剂;
D、水分子中既含σ键,又含有π键;
(4)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是
A.氧原子的杂化类型发生了改变 B.微粒的空间构型发生了改变
C.微粒的化学性质发生了改变
(5)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是 (请用相应的编号填写)
(6)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(7)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广西桂林十八中高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列有关于晶体的说法错误的是
A.金刚石的网状结构中,以共价键形成的最小碳环上有6个碳原子
B.氯化铯晶体中,每个Cs+周围紧邻8个Cl-
C.氯化钠晶体中,每个Na+周围距离最近且相等的Na+共有6个
D.石墨晶体中,每一层内碳原子数与碳碳键数之比为2﹕3
查看答案和解析>>
科目:高中化学 来源:2012届湖北省襄阳四校高二下学期期中联考化学试卷 题型:填空题
(12分)水是自然界中普遍存在的一种重要物质,根据下列信息回答问题:
(1)氧原子基态时价层电子的电子排布图为____________。
(2)已知2H2O  H3O+
+ OH—,H3O+的立体构型是___________________,中心原子的杂化类型是__________________。
H3O+
+ OH—,H3O+的立体构型是___________________,中心原子的杂化类型是__________________。
(3)下列关于水的说法正确的是__________(选填序号)。
① 在冰晶体中每一个水分子内含有两个氢键;
② 水分子是由极性键构成的极性分子;
③ 水在化学反应中可以作氧化剂,也可以作还原剂;
④ 水分子中既含σ键,又含有π键;
⑤ 纯水呈中性,所以在任何条件下纯水的PH均为7;
⑥ 水分子中的氧原子的杂化类型是SP3杂化,价层电子对数是2。
(4)试比较同主族元素的氢化物H2O、H2S和H2Se的稳定性和沸点高低。
稳定性: 沸点:
查看答案和解析>>
科目:高中化学 来源:2012届河北省高二下学期期末考试化学试卷 题型:填空题
(12分) 水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。根据下列信息回答问题:
(1)基态氧原子价层电子的电子排布图为____________
(2)写出两种与H2O分子互为等电子体的微粒 、
(3)下列关于水的说法正确的是__________(选填序号)。
A、纯水呈中性,所以在任何条件下纯水的pH均为7;
B、水分子是由极性键构成的极性分子;
C、水在化学反应中可以作氧化剂,也可以作还原剂;
D、水分子中既含σ键,又含有π键;
(4)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是
A.氧原子的杂化类型发生了改变 B.微粒的空间构型发生了改变
C.微粒的化学性质发生了改变
(5)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是 (请用相应的编号填写)

(6)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;

(7)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com