
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| H | + 4 |
| O | - 2 |
| H | + 4 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年河南省信阳市高三第二次调研考试化学试卷 题型:填空题
(18分)(1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O,
写出该反应的化学方程式并配平_________________________________。若反应过程中
转移了0.3mol电子,则氧化产物的质量是____________g。
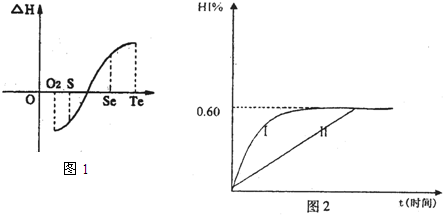
(2)同一物质呈气态的熵值最大,液态的熵值次之,固态的熵值最小。若同温同压下一个化学反应生成物气体的体积等于反应物气体的体积就可以粗略认为该反应的熵变为0。某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。所查资料如下:
a.碲(Te)为固体,H2Te为气体,Te和H2不能直接化合生成H2Te
b.等物质的量氧气、硫、硒、碲与H2反应的焓变情况如图l所示:
请回答下列问题:
H2与硫化合的反应______________热量(填“放出”或“吸收”)。根据题目所给信息,请解释为什么Te和H2不能直接化合_________________________________________.
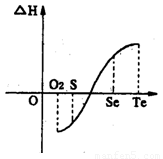
(3)在复杂的反应中,要考虑反应的先后顺序。已知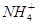 +
+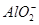 +2H2O
+2H2O Al(OH)3↓ +NH3·H2O,向含有等物质的量的
Al(OH)3↓ +NH3·H2O,向含有等物质的量的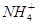 、Al3+、H+混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应;其中:
、Al3+、H+混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应;其中:
第二个离子反应的离子方程式是__________________________________.
最后—个离子反应的离子方程式是________________________________.
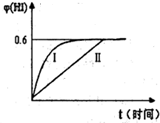
(4)将1mol I2(g)和2mol H2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g) 2HI(g);△H<0。 并达平衡。HI的体积分数HI%随时问变化曲线如图2所示:
2HI(g);△H<0。 并达平衡。HI的体积分数HI%随时问变化曲线如图2所示:
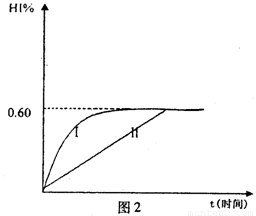
①达到平衡时,I2(g)的物质的量浓度为________mol/L.
②保持加入的反应物的物质的量不变,若改变反应条件,在某一条件下HI%的变化如曲线l所示,则该条件可能是(写出所有的可能性)___________________________________________________________在这种条件下,平衡常数K值____________(填“增大”、“变小”、。不变”或“可能变大也可能变小”)
③若保持温度不变,在另一相同的2L密闭容器中加入1molH2(g)和2molHI(g),发生反应达到平衡时,H2的体积分数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com