
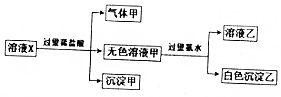
 水溶液中只可能有K+、Mg2+、AlO2-、Al3+、SiO32-、CO32-、SO42-中的若干种离子,某同学对溶液进行了如下实验:下列判断错误的是( )
水溶液中只可能有K+、Mg2+、AlO2-、Al3+、SiO32-、CO32-、SO42-中的若干种离子,某同学对溶液进行了如下实验:下列判断错误的是( )| A. | 溶液X可能含有Mg2+或Al3+ | |
| B. | 沉淀甲只可能是硅酸沉淀 | |
| C. | 有气体甲生成,表明溶液X中一定含有CO32- | |
| D. | 不能确定SO42-是否存在于溶液X中 |
分析 溶液X中进入过量盐酸,生成的气体甲,气体甲为二氧化碳,则原溶液中含有CO32-,根据离子共存可知溶液中一定不存在Mg2+、Al3+;再根据溶液电中性可知,原溶液中一定存在唯一的阳离子K+;
加入盐酸生成了沉淀甲,该沉淀只能为硅酸,原溶液中一定存在SiO32-;
无色溶液甲中加入过量氨水,得到的白色沉淀,该沉淀为氢氧化铝,说明原溶液中一定存在AlO2-,白色沉淀乙为氢氧化铝,据此进行解答.
解答 解:溶液X中进入过量盐酸,生成的气体甲,气体甲为二氧化碳,则原溶液中含有CO32-,根据离子共存可知溶液中一定不存在Mg2+、Al3+;再根据溶液电中性可知,原溶液中一定存在唯一的阳离子K+;
加入盐酸生成了沉淀甲,该沉淀只能为硅酸,原溶液中一定存在SiO32-;
无色溶液甲中加入过量氨水,得到的白色沉淀,该沉淀为氢氧化铝,说明原溶液中一定存在AlO2-,白色沉淀乙为氢氧化铝,
A.根据分析可知,溶液X中一定不存在Mg2+、Al3+,故A错误;
B.白色沉淀只能为硅酸根离子与氢离子反应生成的硅酸,故B正确;
C.只有CO32-与稀盐酸反应生成二氧化碳,表明溶液X中一定含有CO32-,故C正确;
D.根据分析可知,无法确定原溶液中是否含有硫酸根离子,故D正确;
故选A.
点评 本题考查常见离子的检验方法,题目难度中等,注意掌握常见离子的性质及检验方法,要求学生能够根据反应现象判断离子存在情况,试题有利于提高学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:选择题
| A. | a+m=b-n | B. | a+b=m+n | C. | a-m=b+n | D. | a+m=b-n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
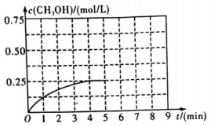 在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g)?CH3OH(g)△H=-dkJ•mol-1(d>0).初始投料与各容器达到平衡时的有关数据如表:
在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g)?CH3OH(g)△H=-dkJ•mol-1(d>0).初始投料与各容器达到平衡时的有关数据如表:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2mol H2、1mol CO | 1mol CH3OH | 4mol H2、2mol CO |
| 平衡时n(CH3OH) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1KJ | 吸收Q2KJ | 放出Q3KJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
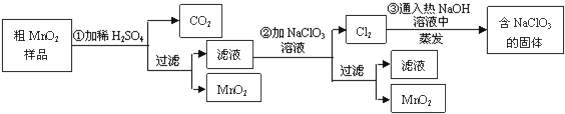
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
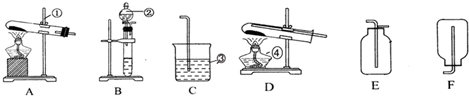
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>E>D | B. | A>B>D>E | C. | D>A>B>E | D. | D>E>A>B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com