
| A. | CO2 | B. | 水 | ||
| C. | 干沙 | D. | 干粉(含NaHCO3)灭火剂 |
科目:高中化学 来源: 题型:选择题
| A. | 油脂属于酯类,在酸性或碱性条件下与水发生水解反应,称为皂化反应 | |
| B. | 淀粉、纤维素没有甜味,它们都是天然高分子化合物,在一定条件下水解都能生成葡萄糖 | |
| C. | 鸡蛋清的溶液中加入硫酸铜溶液,鸡蛋清凝聚,蛋白质变性 | |
| D. | 氨基酸分子中都含有-COOH和-NH2二种原子团,能相互反应形成更复杂的多肽化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的还原产物是 I2 | |
| B. | 每生成 1 mol I2,转移的电子为 2 mol | |
| C. | KOH 和 O2 都是还原产物 | |
| D. | 反应中氧化剂与还原剂质量之比为 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 950mL,111.2g | B. | 500mL,117g | C. | 1000mL,l17g | D. | 任意规格,117g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙醇中含有的氧原子数为NA | |
| B. | 64g的S2和S8混合物中,含硫原子总数为2 NA | |
| C. | 1L 1mol/L氯化铁溶液中,含有NA个Fe3+ | |
| D. | 25℃时,pH=13的Ba(OH)2溶液中含有OH-数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
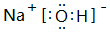 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸与氢氧化钠溶液的反应:H++OH-=H2O | |
| B. | 钠与水反应:Na+H2O=Na++OH-+H2↑ | |
| C. | 氯气与氯化亚铁溶液的反应:Cl2+2Fe2+=2Cl-+2Fe3+ | |
| D. | 碳酸钙溶液与足量稀盐酸的反应:CO32-+2H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

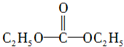 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com