
| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
分析 Ⅰ.(1)根据乙醛的结构、化学性质判断乙醛与溴水可能发生的反应类型;
(2)根据①乙醛与溴发生取代反应和③发生氧化还原反应后的溶液都为酸性溶液分析;
(3)由于乙醛是足量的,溴水中的溴全部参与反应:取代反应后生成n(Br-)=a mol,加成反应后n(Br-)=0 mol,氧化反应后n(Br-)=2amol据此进行解答;
(4)依据加入过量AgN03溶液,得到淡黄色沉淀为AgBr,根据质量求出其物质的量,再分析反应;
Ⅱ.(1)根据乙醛与氧气发生氧化反应生成乙酸;
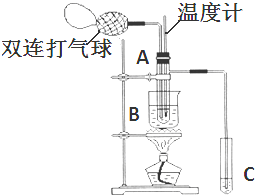
(2)根据实验开始时温度计应测量反应的温度,控制反应温度为60℃~80℃;根据蒸馏原理,温度计测量的是蒸气的温度;
(3)根据乙酸的沸点为117.9℃,要想通过蒸馏的方法得到乙酸,B内盛装的液体的沸点应大于117.9℃.
解答 解:Ⅰ(1)由于乙醛是足量的,溴水中的溴全部参与反应,可能发生的反应有三种情况:取代反应、加成反应、氧化反应,所以②为溴与乙醛发生加成反应,
故答案为:溴与乙醛发生加成反应;
(2)由于乙醛与溴发生取代反应,反应后溶液为酸性,而发生氧化还原反应后的溶液也是酸性,所以无法通过测定溶液的pH判断反应原理,
故答案为:否;不论是发生取代反应还是发生氧化反应,溶液的酸性均增强;
(3)由于乙醛是足量的,乙醛中官能团为-CHO,溴水中的溴全部参与反应:取代反应后生成n(Br-)=a mol,加成反应后n(Br-)=0 mol,氧化反应后n(Br-)=2amol,
故答案为:a;
(4)得到固体1.88g为AgBr的质量,n(AgBr)=$\frac{1.88g}{188g/mol}$=0.01mol,10mL含0.005mol Br2,n(Br-)=2n(Br2),则反应应为氧化反应,其反应方程式为:CH3CHO+Br2+H2O→CH3COOH+2HBr;
故答案为:CH3CHO+Br2+H2O→CH3COOH+2HBr;
Ⅱ(1)乙醛与氧气发生氧化反应生成乙酸,方程式为:2CH3CHO+O2$→_{CuO}^{60℃-80℃}$2CH3COOH,故答案为:2CH3CHO+O2$→_{CuO}^{60℃-80℃}$2CH3COOH;
(2)实验开始时温度计应测量反应的温度,控制反应温度为60℃~80℃,所以实验开始时温度计水银球的位置应在试管A的反应液中;由蒸馏原理可知,温度计测量的是蒸气的温度,所以温度计水银球的位置应在试管A的支管口处,
故答案为:试管A的反应液中;测量反应溶液的温度;试管A的支管口处;收集含乙酸的馏分;
(3)乙酸的沸点为117.9℃,要想通过蒸馏的方法得到乙酸,B内盛装的液体的沸点应大于117.9℃,由表可知烧杯B内盛装的液体可以是乙二醇或甘油,
故答案为:乙二醇或甘油(只写一个).
点评 本题考查了醛基官能团的性质和检验应用,乙醇的催化氧化实验以及乙酸的制备,注意从取代反应、加成反应、氧化反应的反应特征分析,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氟利昂(CCl2F2)会破坏大气臭氧层从而导致“温室效应” | |
| B. | 开发高效氢能、太阳能灯新能源汽车,可以减缓城市机动车尾气污染 | |
| C. | PM2.5是指大气中直径接近2.5×10-6m的颗粒物,它分散在空气中形成胶体 | |
| D. | 海水淡化可以解决淡水危机,向海水中加入明矾可以使海水淡化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是酸性氧化物,可制成玻璃容器盛装氢氟酸 | |
| B. | 氧化铁为红棕色固体,可用于作油漆红色涂料 | |
| C. | 次氯酸有酸性,可用于自来水的杀菌消毒 | |
| D. | 钠具有金属活泼性,钠可以从硫酸铜溶液中置换出金属铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
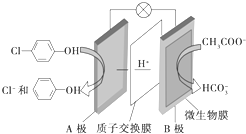 含乙酸钠和对氯酚
含乙酸钠和对氯酚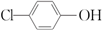 的废水可以利用微生物电池处理,其原理如图所示.下列说法中正确的是( )
的废水可以利用微生物电池处理,其原理如图所示.下列说法中正确的是( )| A. | B极是电池的正极 | |
| B. | H+向A极移动 | |
| C. | B极的电极反应式为CH3COO-+8e-+4H2O═2HCO3-+9H+ | |
| D. | 此电池可以在高温下使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属冶炼的本质是将化合态金属还原为游离态,冶炼方法由金属的活泼性决定 | |
| B. | Cu的湿法冶炼是将金属钠投入到CuSO4溶液中置换出铜 | |
| C. | 炼铁时加入石灰石的目的是除去过量的碳 | |
| D. | 由于Al的活泼性强,故工业上采用电解熔融AlCl3的方法生产Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
| Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 | 6.5×10-18 |
| 完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅的导电性介于金属和绝缘体之间,是良好的半导体 | |
| B. | 加热到一定温度时,硅能与氯气、氧气等非金属反应 | |
| C. | 利用二氧化硅与C反应能制得粗硅 | |
| D. | 二氧化硅性质较稳定,常温下不与任何物质反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com