
| A. | 常用作净水剂的KAl(SO4)2和漂白粉都是强电解质 | |
| B. | 氯气溶于水生成的次氯酸具有强氧化性,可以起到除去水中杂质和杀菌消毒作用 | |
| C. | 氮氧化物可以破坏臭氧层,也能形成酸雨 | |
| D. | “玉兔”月球车太阳能电池板可将光能转换为电能,所用转换材料是二氧化硅 |
分析 A、强电解质是在水溶液中或熔融状态下能完全电离的化合物;
B、HClO有强氧化性,能杀菌消毒;
C、氮氧化物能引起酸雨、光化学烟雾、破坏臭氧层;
D、太阳能电池板的材料是单质硅.
解答 解:A、强电解质是在水溶液中或熔融状态下能完全电离的化合物,而漂白粉是次氯酸钙和氯化钙的混合物,故不是强电解质,故A错误;
B、HClO有强氧化性,能杀菌消毒,但不能除去水中的杂质,故B错误;
C、氮氧化物能引起酸雨、光化学烟雾,在粉尘作用下使臭氧转化为氧气,从而破坏臭氧层,故C正确;
D、太阳能电池板的材料是单质硅,不是二氧化硅,故D错误.
故选C.
点评 本题考查化学与生活、生产、环境的关系,明确物质的性质及化学与生活、生产的联系即可解答,注意化学应服务于生活、生产,并关注环境保护问题,题目难度不大.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮罐贮运浓硫酸 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 检验Fe(NO3)2晶体是否已氧化变质,将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 | |
| D. | 常温下将Al片放入浓硝酸中,无明显变化,所以Al与浓硝酸不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、N2、NO、NO2 | B. | NO、NO2、N2O、N2O3 | ||
| C. | N2、N2O、NO2、N2O5 | D. | NH3、NO2、N2O4、HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能只有甲烷 | B. | 可能只有氢气 | ||
| C. | 可能是甲烷和一氧化碳 | D. | 可能3种气体都存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
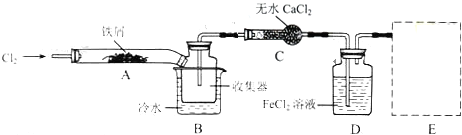
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②③ | B. | 只有①②③④ | C. | ①②③④⑤ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com