
硅及其化合物在材料领域中应用广泛.下列叙述中不正确的是( )
A. 硅单质可用来制造太阳能电池
B. 装碱性溶液的玻璃试剂瓶不能用玻璃塞
C. 二氧化硅是制造光导纤维的材料
D. 二氧化硅属于酸性氧化物,不能与任何酸反应
科目:高中化学 来源: 题型:
如图为含有同一种元素的a、b、c、d、e五种物质的转化关系.其中a是单质,b是气态氢化物,c、d是氧化物,e是该元素最高价氧化物对应的水化物,则a可能是()
①C②N2③S④F2.
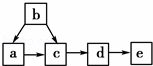
A. 只有①和③ B. 只有④ C. ①②③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
将Mg条、Al条平行插入一定浓度的NaOH溶液中,用导线、电流计连接成原电池,此电池工作时,下列叙述中正确的是()
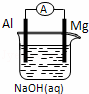
A. Mg比Al活泼,Mg 失去电子被氧化成Mg2+
B. 负极反应式为:Al+4OH﹣﹣3e﹣=AlO2﹣+2H2O
C. 该电池的内外电路中,电流均是由电子定向移动形成的
D. Al是电池阴极,开始工作时溶液中会立即有白色沉淀析出
查看答案和解析>>
科目:高中化学 来源: 题型:
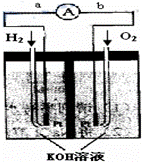
氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示).
(2)负极反应式为 .
(3)电极表面镀铂粉的原因为增
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:Ⅰ.2Li+H2 2LiHⅡ.LiH+H2O═LiOH+H2↑
2LiHⅡ.LiH+H2O═LiOH+H2↑
①反应Ⅰ中的还原剂是Li,反应Ⅱ中的氧化剂是H2O.
②用锂吸收224L(标准状况)H2,再由生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 .
③若改用熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极.已知负极的电极反应是CH4+4CO32﹣﹣8e﹣=5CO2+2H2O.则正极的电极反应是 .为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,此电池工作时必须有部分A物质参加循环,则A物质的化学式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,某密闭容器中发生反应:N2(g)+3H2(g)═2NH3(g).反应物N2的浓度10s内从2mol/L降为1mol/L,在这段时间内用N2浓度的变化表示的反应速率为( )
A. 0.05 mol/(L•s) B. 0.1 mol/(L•s) C. 0.15 mol/(L•s) D. 0.2 mol/(L•s)
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素的一个原子形成的离子可表示为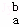 Xn﹣,下列说法正确的是( )
Xn﹣,下列说法正确的是( )
A. 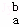 Xn﹣含有的中子数为a+b
Xn﹣含有的中子数为a+b
B. 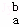 Xn﹣含有的电子数为a﹣n
Xn﹣含有的电子数为a﹣n
C. X原子的质量数为a+b+n
D. 一个X原子的质量约为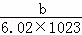 g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 增大压强,活化分子数增加,化学反应速率一定增大
B. 升高温度,活化分子百分数增加,化学反应速率一定增大
C. 活化分子间所发生的分子间的碰撞为有效碰撞
D. 加入反应物,使活化分子百分数增加,化学反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于0.10mol•L﹣1 NaHCO3溶液的说法正确的是()
A. 溶质的电离方程式为NaHCO3═Na++H++CO32﹣
B. 25℃时,加水稀释后,n(H+)与n(OH﹣)的乘积变大
C. 离子浓度关系:c(Na+)+c(H+)=c(OH﹣)+c(HCO3﹣)+c(CO32﹣)
D. 温度升高,c(HCO3﹣)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com