
| A、Cl2+2Fe2+→2Cl-+2Fe3+ |
| B、2Cl2+2Fe2++2I-=2Fe3++4Cl-+I2 |
| C、3Cl2+2Fe2++4Br-→2Fe3++6Cl-+2Br2 |
| D、6Cl2+6Fe2++4I-+2Br-=6Fe3++12Cl-+2I2+Br2 |


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
| A、硝酸的摩尔质量和6.02×1023个硝酸分子的质量(以克为单位)在数值上相等 |
| B、6.02×10个氮气分子和6.02×1023个氢气分子的质量比等于14:1 |
| C、32g氧气所含的原子数目约为2×6.02×1023 |
| D、通常情况下,近似值6.02×1023就是我们所说的阿伏伽德罗常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
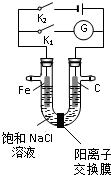
| A、K1闭合,铁棒侧溶液会出现白色沉淀,而且沉淀最终变为红褐色 |
| B、K1或K2闭合,石墨棒周围溶液pH均升高 |
| C、K2闭合,铁棒上发生的反应为2Cl--2e-=Cl2↑ |
| D、K2闭合,电路中通过0.002 NA个电子时,两极共产生0.002mol气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
| B、核外电子排布相同的微粒化学性质也相同 |
| C、Cl-、S2-、Ca2+、K+半径逐渐减小 |
| D、1735 Cl 与 1737 Cl 得电子能力相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
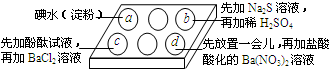 为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3 溶液,再分别滴加用如图所示的试剂对实验现象的“解释或结论”错误的是( )
为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3 溶液,再分别滴加用如图所示的试剂对实验现象的“解释或结论”错误的是( )| 选项 | 实验现象 | 解释或结论 |
| A | a中溶液褪色 | 还原性:SO32-<I- |
| B | b中加硫酸后产生淡黄色沉淀 | SO32-和S2-在酸性条件下发生反应 |
| C | c中滴入酚酞溶液变红,再加BaCl2溶液后产生白色沉淀且红色褪去 | SO32-+H2O?HSO3-+OH-,所以滴入酚酞变红; Ba2++SO32-→BaSO3↓(白),使水解平衡左移,红色褪去 |
| D | d中产生白色沉淀 | Na2SO3溶液已被氧化变质 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
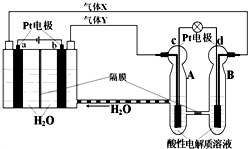 RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池,RFC工作原理见图.下列有关说法正确的是( )
RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池,RFC工作原理见图.下列有关说法正确的是( )| A、转移0.1mol电子时,a电极产生标准状况下O21.12L |
| B、b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH- |
| C、c电极上进行还原反应,B池中的H+可以通过隔膜进入A池 |
| D、d电极上发生的电极反应是:O2+4H++4e-=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、推广使用燃煤脱硫技术,防治SO2污染 |
| B、实施绿化工程,防治扬尘污染 |
| C、采用“绿色化学”工艺,使原料尽可能转化为所需要的物质,减少废气排放 |
| D、加大石油、煤炭的开采速度,增加化石燃料的供应量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com